
科目: 来源: 题型:
【题目】如图是钢铁电化学保护的示意图。分析正确的是

A. 若a、b两端用导线相连,Fe作正极
B. 若a、b两端用导线相连,Zn被还原
C. 若a、b两端与电源相连,Fe作阳极
D. 若a、b两端与电源相连,Zn极得电子
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:

(1)正反应是___热反应。
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____ 热反应,m+n___p+q(填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知: CO可将部分氮的氧化物还原为N2。
反应I :2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II :4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g) ![]() CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
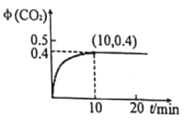
①达到平衡状态时,SO2的转化率为__,该温度下反应的平衡常数K=______。
②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:

图中A点处NO的转化率_______(填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
(5)2SO2(g)+O2(g) ![]() 2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。

查看答案和解析>>
科目: 来源: 题型:
【题目】白藜芦醇被称之为继紫杉醇之后又一绿色抗癌药物,目前在保健品、食品、化妆品等诸多领域都有了广泛的应用。其合成路线如下:

回答下列问题:
(1)物质A中官能团的电子式为____,合成路线中设置反应①的目的是____。
(2)化合物X的蒸气密度是相同条件下H2密度的51倍,则X的结构简式为____。
(3)在反应①~④中属于取代反应的有____。
(4)Y核磁共振氢谱有____组峰,其峰面积之比为____。任写一种与Y核磁共振氢谱峰组数相同、峰面积之比也相同的同分异构体的结构简式____。
(5)反应⑤的化学方程式为____。
(6)白藜芦醇与溴水反应时,1 mol白藜芦醇最多可消耗____mol Br2。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。
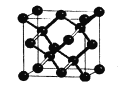
(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。

硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。

硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为_____;
(2)9.5克某金属氯化物MCl2 中含有0.200molCl-,则该氯化物的摩尔质量为 ______________,金属M的相对原子质量为 ______________。
(3)同温同压时,某气体A对氢气的相对密度为22。则在标准状况下,气体A的密度为________g/L ,质量为4.4g的气体A所含有的分子数约为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,HX溶液、HY溶液、HY和NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是

A. HX、HY均为一元强酸
B. 溶液中水的电离程度:a = b < c
C. 常温下,HY的电离常数Ka约为1.0×10-4
D. c点溶液:c(Na+)>c(Y-)>c(HY) >c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,可用铬铁矿(主要成分为FeCr2O4,含有SiO2、Al2O3等杂质)冶炼金属铬。回答下列问题:
I.焦炭冶炼法。反应的化学方程式为FeCr2O4+4C![]() Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Ⅱ.铝热冶炼法。冶炼流程如下:

已知:4FeCr2O4+8Na2CO3 +7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①所得浸出液中的阴离子除CrO42-、CO32-、OH-外,还有____(忽略水解,填化学式)。
(2)步骤③需将pH调____(填“大”或“小”)。
(3)步骤④反应的离子方程式为____。若加H2SO4前c(CrO42-) =0. 020 mol/L,将溶液pH调至3时CrO42-浓度降为1.0×10-5 mol/L(加入H2SO4引起的体积变化可忽略),则该反应的平衡常数为____
(4)相关物质的溶解度曲线如图。步骤⑤需先得到较纯的 Na2Cr2O7·2H2O晶体,其操作方法是____。

(5)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,该反应中氧化剂与还原剂的物质的量之比为 ___。可改用Na2 CrO4和Na2S反应得到Cr(OH)3,再热分 解得到Cr2O3。请配平下列化学方程式:___Na2CrO4+___Na2S+___H2O =___Cr(OH)3+___Na2 S2O3+___NaOH___
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸工业和合成氨工业是衡量一个国家工业发展水平的重要指标,下图是硫酸工业和合成氨工业联合生产示意图:

回答下列问题:
(1)已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=akJ/mol
SO2 (g)=S(s)+O2(g)△H=bkJ/mol
Fe(s)+2S(s)=Fe2S(s)△H=ckJ/mol
沸腾炉中主要反应的热化学方程式为____。
(2)如果生产过程中H2的总转化率为90%,FeS2的总转化率为95%,氨与硫酸生成硫酸铵的转化率为100%,则最初FeS2和H2的物质的量之比为 ___。
(3)在一定条件下,分别向体积相同的恒容密闭容器甲,乙、丙中通入一定量的N2、H2或 NH3,发生反应:N2 (g)+3H2=2NH3 (g),相关数据如下:

①乙中NH3的转化率为 ___,丙中x的取值范围为 ___。
②在t1时升高甲容器的温度,至t2时再次达到平衡,测得t2时 混合气体的平均摩尔质量比tl时小。请在图中画出tl~t2 时间段正反应速率的变化示意图______________。

(4)尾气中含有SO2,直接排放会造成环境污染,可用Fe2(SO4)3 溶液吸收。某科研团队对pH、c(Fe3+)、温度等因素对SO2最 高吸收率的影响进行研究,结果如图:

40℃时SO2的最高吸收率随pH、c(Fe3+)的增大而 __,其原因是 ___;温度高于 40℃后,SO2的最高吸收率随温度的升高而减小,其原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com