
科目: 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5和PM10都是空气质量指数(AQI)的重要指标
B. 汽车尾气中的NO2和CO2都是大气污染
C. 聚乙烯和聚氯乙烯随意乱扔都能产生白色污染
D. 含N和P的大量污水任意排放都能导致水体富营养化
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A. 无色溶液:K+、Cl- 、Mg2+、SO42-、Cr2O72-
B. 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C. Na2CO3溶液:K+、Fe3+、SO42-、NO3-
D. ![]() =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是测定某补血剂(FeSO47H2O)中铁元素含量的流程图。根据题意完成下列填空:

(1)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的玻璃仪器有量筒、烧杯、胶头滴管、_________及__________。H2O2的作用是_____________。
(2)步骤Ⅴ一系列操作依次是:①过滤②洗涤③_________④冷却⑤称量⑥恒重操作。操作⑥的目的是____________________;证明操作②是否洗涤干净的操作________________。
(3)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾FeSO47H2O广泛用于医药和工业领域。以下是FeSO47H2O的实验室制备流程图。根据题意完成下列填空:

(1)碳酸钠溶液能除去酯类油污,是因为_________________________(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是______________________________。
(2)废铁屑中含氧化铁,反应II的离子方程式____________________,判断反应II完成的现象是: ______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将12.8g两种金属的混合物投入足量的盐酸中,反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是( )
A.钙和锌B.镁和铜C.铝和镁D.钠和铁
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物E是香料、染料的中间体,一种合成路线如下:
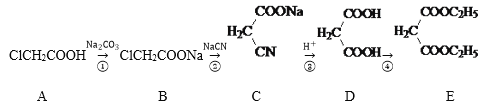
回答下列问题:
(1)A中官能团名称为______________,②的反应类型是___________。1molA与NaOH热溶液充分反应消耗NaOH的物质的量为__________mol。
(2)分别写出反应②和反应④化学方程式。
反应②__________________________________________________
反应④__________________________________________________
(3)写出与D互为同分异构体的含酯基化合物的结构简式____________________。
(4)乙酸甲酯(CH3COOCH3)可用作溶纤剂、喷漆溶剂,以及用于制备人造革。设计由甲醇为起始原料制备乙酸甲酯(CH3COOCH3)的合成路线(无机试剂任选)。合成路线常用的表示方式为:A![]() B
B![]()
![]() 目标产物 ___________________________。
目标产物 ___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组进行了下列关于氯化铵的课外实验:
(实验操作)

浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(1)氯化铵饱和溶液中离子浓度由大到小的顺序是________。白烟的成分是______________。
(2)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因(写出一条即可)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)+Q
2NH3(g)+Q
(1)写出该反应的逆反应的化学平衡常数表达式_____,升高温度,该反应化学反应速率_____,氢气的转化率____(以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是__________。
(2)能表示该反应在恒温恒容密闭容器中t1时刻后已经达到平衡状态的图示是________。

(3)浓度0.1mol/L的氨水,pH为11。当用蒸馏水稀释100倍时,则NH3·H2O的电离平衡将向______方向移动(填“正”或“逆”),溶液的pH将为____9(“大于”“小于”“等于”)。设计一个简单实验,证明一水合氨是弱碱:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验不能达到预期实验目的是()
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com