
科目: 来源: 题型:
【题目】在体积恒定的密闭容器中发生反应N2O4(g)![]() 2NO2(g) ΔH>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )

A. 用图甲所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体
B. 按装置乙所示的气流方向可用于收集H2、NO等
C. 用图丙所示装置,分离CCl4萃取碘水后的有机层和水层
D. 用图丁所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(![]() )与立方烷(
)与立方烷(![]() )的二氯代物数目相同
)的二氯代物数目相同
查看答案和解析>>
科目: 来源: 题型:
【题目】电解饱和食盐水,2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是
H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是

A. 在X极生成2mol Cl2 B. 在X极生成2molH2
C. 在Y极生成4mol Cl2 D. NaOH在Y极生成
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。

已知:
回答下列问题:
(1)化合物C中的含氧官能团名称为_________,A到B的反应类型为__________。
(2)A的名称为____________
(3)写出D的结构简式:_____________________________。
(4)写出反应②的化学方程式:____________________________________________。
(5)化合物C满足下列条件的同分异构体有_______种,写出其中一种有5种不同种类氢原子的同分异构体的结构简式:_______________。
①含苯环结构,能在碱性条件下发生水解;
②能与FeCl3发生显色反应;
③能发生银镜反应。
(6)已知CH3CH2CN![]() CH3CH2COOH。请以
CH3CH2COOH。请以 、CH2=CHCN和乙醇为原料合成化合物
、CH2=CHCN和乙醇为原料合成化合物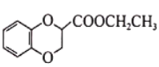 ,写出制备的合成路线流程图(无机试剂任用)____________________
,写出制备的合成路线流程图(无机试剂任用)____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
化学键 | H-C | C=C | H-O | C-O | C-C |
键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目: 来源: 题型:
【题目】五氧化二钒及其他钒的化合物广泛应用于钢铁、有色合金、化工、炼油、玻璃及陶瓷等工业部门。可从含钒石煤灰渣中提钒,该试验工艺流程如下图:

表1 灰渣主要化学成分分析/%
V2O3 | SiO2 | Fe2O3 | Al2O3 | MgO | K2O | CaO | 烧失量 |
1.26 | 55.71 | 6.34 | 7.54 | 1.26 | 3.19 | 1.41 | 20.55 |
表2中间盐主要成分分析/%(以氧化物形式表示其含量)
V2O3 | Al2O3 | Fe2O3 | MgO | K2O |
5.92 | 1.70 | 18.63 | 2.11 | 3.38 |
已知:
①石煤灰渣的化学成分分析见表1,中间盐的主要成分分析见表2。
②矿物焙烧过程中,若温度过高,易发生烧结,温度越高,烧结现象越严重。
③萃取反应可以表示为:VO2++(HR2)PO4(o)→VO[R2PO4]R(o)+H+,(o)表示有机相
④有机萃取剂(HR2)PO4萃取VO2+的能力比萃取V02+要强。
请回答:
(1)提高浸取率的方法有____________,残渣的主要成分为______________________,
(2)经几级萃取后,有时候要适当加酸调整pH值,结合萃取反应方程式,说明原因_____________。反萃取操作应加入_____________试剂。
(3)中间盐溶解过程中,加铁粉的主要目的是_____________________。
(4)石煤中的钒以V(Ⅲ)为主,有部分V(Ⅳ),很少见V(Ⅴ)。如图1和如图2分别为焙烧温度和焙烧时间对钒浸出率的影响,由如图2可得最佳焙烧时间为______________h,由如图1可得最佳焙烧温度为800-850℃之间,焙烧温度在850℃以下时,钒浸出率随焙烧温度的上升几乎直线上升的原因是_________________________,当焙烧温度高超过850℃以后,再提高温度,浸出率反而下降的可能原因是:_________________________。

(5)反萃取液中的VO2+,加入氯酸钠后被氧化为VO2+,请写出该反应的离子方程式______________。然后用氨水调节pH到1.9~2.2沉钒,得多钒酸铵沉淀(化学式为(NH4)2V12O31·nH2O),再经固液分离、干燥、焙烧得五氧化二钒产品,请写出此步反应的化学方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com