
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H
已知:CH3OCH3(g) ![]() CO(g)+H2(g)+CH4 (g) △H1
CO(g)+H2(g)+CH4 (g) △H1
CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
H2(g)+1/2O2(g)=H2O (g) △H3
①则反应I的△H=____(用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当n(O2)/n(CH3OCH3)>0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C .n(O2)/n(CH3OCH3)>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。

①t=400 s时,CH3OCH3的转化率为____(保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_____s-1;400 s时v(CH3OCH3)=_____kPa.s-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________ kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是____,其理由是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2+O2![]() 2SO3是工业制硫酸的一步重要反应,下列说法正确的是
2SO3是工业制硫酸的一步重要反应,下列说法正确的是
A. 使用催化剂能改变该反应限度
B. 减小SO2的浓度能加快该反应的速率
C. 升高体系温度能加快反应速率
D. 1 mol SO2和足量的O2在一定条件下充分反应,生成1 mol SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
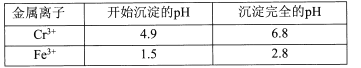
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。

①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
(1)制备无水氯化铁

①仪器X的名称为____。
②装置的连接顺序为a→____→i,k→____(按气流方向,用小写字母表示)。
③实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为____。
(2)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①____

②_________
③_________
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)____E(ii)(填“>”、 “<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
⑤另取5 mL l mol![]() L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是____。
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】电解法处理CO2和SO2混合污染气的原理如下图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是

A. Ni电极表面发生了还原反应
B. 阳极的电极反应为:2O2—-4e-=O2
C. 电解质中发生的离子反应有:2SO2 +4O2—=2SO42—
D. 该过程实现了电解质中碳酸盐和硫酸盐的自补充循环
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组制备84消毒液(主要成分NaClO)设计了如图装置。并查阅到下列资料,“在加热情况下卤素和碱液发生如下反应:3X2+6OH-![]() 5X-+XO3+3H2O。”
5X-+XO3+3H2O。”

回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为_______。
(2)装置中能否省去盛饱和NaCl 溶液的洗气瓶?______(填“能”或“不能”,下同),理由是_______。
(3)装置中能否省去盛浓硫酸的洗气瓶?________,理由是________。
(4)装置中能否省去盛冰水的烧杯?______,理由是_______。
查看答案和解析>>
科目: 来源: 题型:
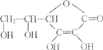
【题目】维生素C又称为抗坏血酸,在人体内有重要功能。其结构简式如图。
请回答下列问题:
(1)维生素C的分子式为_________,维生素C可以治疗的疾病是___________
A.坏血病 B.脑炎 C.骨折 D.肺炎
(2)小明同学在超市中购买了以下食品:苹果、西红柿、薯片、牛肉干,上述食品中,富含维生素C的是______、_______;
(3)铁是人体必需微量元素中含量最多的一种,食物中的Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化成Fe2+,有利于人体吸收,在该化学反应中维生素C体现____________(填“氧化”或“还原”)性。
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
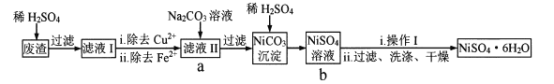
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 8 g S4中,含有质子数为8NA
B. 1 L pH=l的稀H2SO4中,含有H+数目为0.2 NA
C. 甲烷氯代反应中,消耗l mol Cl2生成HCl分子数为NA
D. 密闭容器中,2 mol NO和lmolO2充分反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com