
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
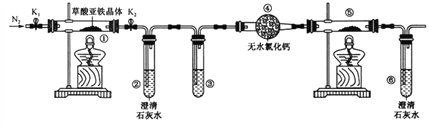
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)![]() X表示原子:
X表示原子:
①AXn+共有x个电子,则该阳离子的中子数N=____。
②12C16O2分子中的中子数N=______。
③A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_____。
(2)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_____。
(3)已知某粒子的结构示意图为![]()
试回答:①当x-y=10时,该粒子为___(填“原子”、“阳离子”或“阴离子”)。
②写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应可视为旧键断裂和新化学键形成的过程。化学键的键能是两个原子间形成1 mol化学键时释放的能量或断开1 mol化学键所吸收的能量。
现提供以下化学键的键能:(kJ·mol1)P—P:198 P—O:360 O==O:498 P==O:585。
则P4(白磷)+5O2![]() P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图
P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图 ,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钨晶体晶胞的结构模型如下图所示。实验测得金属钨的密度为19.30![]() 已知钨的相对原子质量为183.8。回答下列问题:
已知钨的相对原子质量为183.8。回答下列问题:
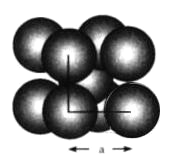
(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为![]() __________
__________![]() 。
。
(3)钨原子的半径为__________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是
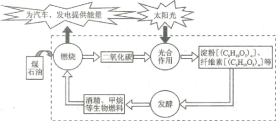
A. 石油与煤是可再生能源
B. CO2是煤、石油形成淀粉、纤维素等的催化剂
C. 光合作用将太阳能转化为化学能
D. 图中所出现的物质中淀粉与纤维素为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)写出元素③的名称__。
(2)①和④号元素形成的化合物的化学式为__,用电子式表示其形成过程为__。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是:__﹥__
(4)①、⑤、⑦号元素形成的一种化合物的电子式是__,在该化合物中既含有__键,又含有__键。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是__________。
(3)本实验用加碱沉淀的目的是否能达到?__________。原因是__________。
(4)加氧化剂的目的为__________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________。如何操作?__________。·
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组用如图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。

回答下列问题:
(1)开始实验之前要进行的操作是__。
(2)写出利用装置I制取氨气的化学方程式__。
(3)按照a、f、e、b、c、d的顺序将仪器连接,装置Ⅲ中倒置漏斗的作用是__,装置IV中仪器的名称为__,盛装的试剂为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
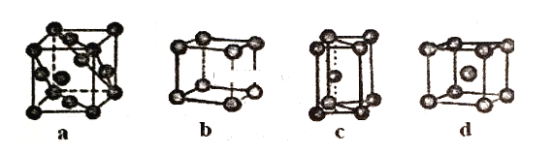
(3)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___ (填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
A.用A表示的化学反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示化学反应速率,其比是3∶2∶1
C.在2min末的反应速率用B表示是0.3mol·L-1·min-1
D.在这2min内B和C两物质的浓度都减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com