
科目: 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )

A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列检验方法和结论正确的是
A.先加入稀盐酸,再滴加硝酸银溶液有白色沉淀生成,则原溶液中一定有Cl-
B.加入氯化钡溶液有白色沉淀生成,则原溶液中一定有SO![]()
C.加入浓NaOH溶液后加热,产生能使湿润的红色石蕊试纸变蓝色的气体,则原溶液中有NH4+
D.加入紫色石蕊试液,溶液显红色,证明溶液一定呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】光卤石是制取钾肥的重要原料,也是提炼金属镁的重要原料。纯净的光卤石的组成可表示为KCl·MgCl2·nH2O。某化学小组为了测定纯净的光卤石的组成,进行如下实验:
实验l:用下图所示装置测定纯净的光卤石中结晶水的含量。

(1)装置A的作用是______________________。装置B中的试剂是___________。装置D的作用是______________________。
(2)实验步骤包括:
①点燃装置C处的酒精灯
②打开装置A处的分液漏斗的活塞
③组装仪器,并检查装置的气密性
④装入药品
⑤关闭装置A处的分液漏斗的活塞
⑥熄灭装置C处的酒精灯
上述实验步骤的先后顺序为______________________(填序号)。
(3)写出装置C中硬质玻璃管内发生反应的化学方程式:___________________________(光卤石用“KCl·MgCl2·nH2O”表示)。
(4)若装置C中硬质玻璃管的质量为a g,实验前称量得硬质玻璃管和样品的总质量为b g,充分反应并冷却后,称量得硬质玻璃管和剩余固体的总质量为c g。则KCl·MgCl2·nH2O 中n=___________ (用含a、b、c的代数式表示)。
实验Ⅱ:测定纯净的光卤石中Mg2+的质量分数。
取wg纯净的光卤石溶于适当过量的稀硝酸中,再用水稀释,配制成250 mL溶液。取25.00 mL所配制的溶液于锥形瓶中,滴几滴K2CrO4溶液(作指示剂),用c mol·L1AgNO3标准溶液滴定至终点,消耗AgNO3标准溶液V mL。
(5)纯净的光卤石中所含Mg2+的质量分数为___________%(用含w、c、V的代数式表示)。
(6)若滴定开始时仰视读数,滴定终点时俯视读数,则测得的结果会___________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂生产的漂白粉,产品说明书如下:
漂白粉使用说明书
主要成分:次氯酸钙、氯化钙
用法用量:每次取漂白粉2 g,水1 000 mL,配成0.2%~0.3%的浊液。
将病人用具浸泡其中5~10分钟,如需要,浓度可提高,时间可延长。
注意事项:……
回答下列问题:
(1)请你为漂白粉写一份保存、使用的注意事项(不超过35字)_____。
(2)用化学方程式表示:
①漂白粉的生产原理:______________;
②一般情况下,漂白粉失效的主要原因:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的有___个( )
①用电子式表示MgCl2的形成过程为:![]()
②两个不同种非金属元素的原子间形成的化学键都是极性键
③离子化合物在熔融状态时能够导电
④含有非极性键的化合物一定是共价化合物
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥次氯酸的电子式:![]()
⑦离子化合物中一定含有离子键
A.1B.2C.3D.4
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。下列说法错误的是( )

A. zh3中各原子最外层都达到8e-稳定结构
B. y与g可形成化合物yg2,结构式为g=y=g
C. d和f形成的简单离子半径大小关系为:d2- < f3+
D. f 和h 形成的化合物属于离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】H(3一溴-5-甲氧基苯甲酸甲酯)是重要的有机物中间体,可以由A(C7H8)通过下图路线 合成。
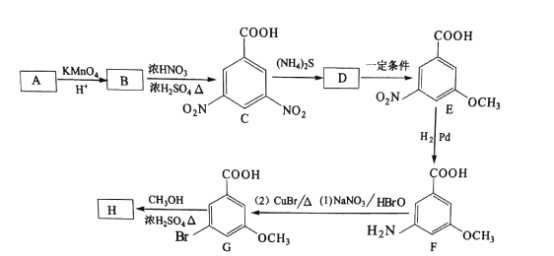
请回答下列问题:
(1)C的化学名称为________,G中所含的官能团有醚键、_______、__________(填名称)。
(2)B的结构简式为________,B生成C的反应类型为___________。
(3)由G生成H的化学方程式为_________。E→F是用“H2/Pd”将硝基转化为氨基,而C→D选用的是(NH4)2S,其可能的原因是________。
(4)化合物F的同分异构体中能同时满足下列条件的共有________种。
①氨基和羟基直接连在苯环上 ②苯环上有三个取代基且能发生水解反应
(5)设计用对硝基乙苯 为起始原料制备化合物
为起始原料制备化合物 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学设计如图装置:

回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为__________________
(2)若丙池盛放足量的CuSO4溶液:①在丙池铁棒这极的现象是____________________。②在丙池中阳极的电极反应是_______________________________________。
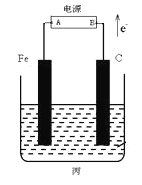
(3)若丙池中盛放滴加少量酚酞的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,___极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②标准状况下,当丙池中有0.1mol电子发生转移时切断电源,则理论上有____ L氯气生成。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,某化学小组拟用该装置制取纯净的O2。

(1)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是___。
(2)若C是一种黑色粉末,则B是_________,C的作用是________________。
(3)广口瓶中盛装的试剂D是___________,其作用是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3min到9min,v(CO2)=__mol·L-1·min-1(计算结果保留2位有效数字)。
(2)能说明上述反应达到平衡状态的是__(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1molH2,同时生成1molCH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为__%。
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是__。
(5)第3分钟时v正(CH3OH)__第9分钟时v逆(CH3OH)(填“>”、“<”“=”或“无法比较”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com