
科目: 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得:
I.制备碳酸亚铁
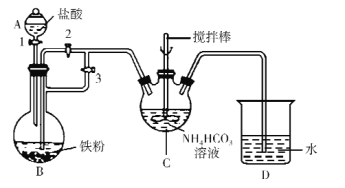
(1)仪器C的名称是_____。
(2)利用如图所示装置进行实验。首先关闭活塞2,打开活塞1、3,目的是____;关闭活塞1,反应一段时间后,关闭活塞____,打开活塞______,观察到B中溶液进入到C中,C中产生沉淀和气体,写出制备FeCO3的离子方程式____。
(3)装置D的作用是____。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是_____。
(5)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是_________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00mL,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示。

则产品中乳酸亚铁晶体的纯度为___%(保留小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数) ( )
A. 124 g P4中含有P—P键的个数为4NA
B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA
D. 60 g SiO2中含有Si—O键的个数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用软锰矿(主要成分为 MnO2,含有杂质 SiO2、Fe2O3)和高品质硫锰矿(主要成 分为 MnS)制取 KMnO4 的一种工艺流程如下图所示。

请回答下列问题:
(1) “酸浸”工序中,MnO2和 MnS中的 Mn元素转化成 MnSO4,同时生成 S 单质,该反应的离子方程式为________________________________________。
(2)为了提高“酸浸”效率,下列方法可行的是_______________________。
A. 将软锰矿和硫锰矿矿石研磨成矿粉 B. 适当提高体系的温度
C. 使用浓盐酸代替稀硫酸进行酸浸 D. 使用搅拌器对混合物进行搅拌
(3)将“滤液Ⅰ”进行处理后,在温度为 50℃,pH 为 6.4~6.8 的电解槽中持续电解,可使 NaClO3复原,同时获得的副产物是 H2,则阳极的电极反应式为______________________________。
(4) “歧化”时,生成物为 K2CO3、KMnO4 和 MnO2。可通过过滤操作分离出 MnO2,并将其循环 到___________工序,以提高原料利用率。然后通过蒸发浓缩、降温结晶、过滤、洗涤、低 温 烘 干 操 作 获 得 KMnO4 固体 , 洗 涤 时 应 使 用 75% 乙 醇 溶 液 对 固 体 进 行 冲 洗 , 其 优 点是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在我国南海、东海海底均存在大量的可燃冰(天然气水合物,可表示为![]() )。
)。
2017年5月,中国首次海域可燃冰试采成功。2017年11月3日,国务院正式批准将可燃冰列为新矿种。可燃冰的开采和利用,既有助于解决人类面临的能源危机,又能生成一系列的工业产品。
(1)对某可燃冰矿样进行定量分析,取一定量样品,释放出的甲烷气体体积折合成标准状况后为166 m3,剩余 H2O 的体积为0.8m3,则该样品的化学式中 x=_________________。
(2)已知下表数据,且知 H2O(l)=H2O(g) △H=+41![]()
化学键 | C—H | O=O | C=O | H—O |
键能/ | 413 | 498 | 803 | 463 |
用甲烷燃烧热表示的热化学方程式为_____________________________________________________。
(3)甲烷燃料电池相较于直接燃烧甲烷有着更高的能量转化效率,某甲烷燃料电池,正极通入空气,以某种金属氧化物为离子导体(金属离子空穴中能传导 O2-),该电池负极的电极反应式为__________________________________________。
(4)甲烷与水蒸气重整制氢是工业上获得氢气的重要手段。若甲烷与脱盐水在一定条件下反应生成H2,同时得到体积比为1:3的CO2和CO,该反应的化学方程式为_____________________________________。混合气体中的CO2可用浓氨水脱除,同时获得氮肥NH4HCO3,该反应的离子方程式是_________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前 5 min 的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时,υ正 > υ逆
C. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ的热量
D. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为 40%
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是未来非常理想能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2+O2。制得的氢气可用于燃料电 池、合成氨工业。回答下列问题:
2H2+O2。制得的氢气可用于燃料电 池、合成氨工业。回答下列问题:
(1)分解海水时,__________能转变为_______________能。生成的氢气用于燃料电池时,___________能转变 为_____能。
(2)氢气可用于合成氨。一定温度下,向2L的密闭容器中加入1 molN2和3molH2 发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得N2的浓度为0.3mol/L,5min时达到平衡,此时测得压强为开始时的
2NH3(g),2min时测得N2的浓度为0.3mol/L,5min时达到平衡,此时测得压强为开始时的![]() 。则前2min用NH3表示的化学反应速率为__________;平衡时,N2的转化率为_________。
。则前2min用NH3表示的化学反应速率为__________;平衡时,N2的转化率为_________。
(3)合成氨还需要大量的氮气为原料,工业上获得大量氮气的方法是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将 CO2 在一定条件下与 H2 反应转化为甲醇(CH3OH)是变废为宝的好办法,一定条件下,每转化 44 kg CO2 放出的热量为 49000 kJ,CO2 转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是

A. 0~3 min 内,用 CO2 和 H2 来表达的平均反应速率相等,均为 0.5 mol/(L·min)
B. 此反应的热化学方程式为 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H = - 49 kJ/mol
C. 此条件下反应的平衡常数K=0.753×1.25/(0.75×0.75)
D. 降低温度,此反应的平衡常数可能为 0.8
查看答案和解析>>
科目: 来源: 题型:
【题目】Co(CH3COO)2(乙酸钴)可用作酯交换反应的催化剂并可用于制备高质量锂电池电极。在氮气氛围中,乙酸钴受热分解生成CO、CO2和C2H6等产物。某研究小组利用下列装置检验乙酸钴热分解的部分产物。

已知:①CO+PdCl2+H2O==CO2+Pd↓(黑色)+2HCl;
②变色硅胶为深蓝色,吸水后变为粉红色。
回答下列问题:
(1)B装置的作用是____,要检验乙酸钴分解产物中的CO2,对以上装置的改进方案是______。
(2)仪器a中的试剂是_______,其作用是_______。
(3)能证明乙酸钴的分解产物含有C2H6的实验现象是______。
(4)装置D中C2H6被CuO完全氧化的化学方程式是________。
(5)另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·nH2O]在空气中加热,样品的固体残留率(![]() ×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式:_____。
×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式:_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】对于恒温、恒容下的反应 2A(g) + 2B(g)3C(g) + D(g),达到平衡状态的是
A. 单位时间内生成 2n mol A,同时生成 3n mol C
B. 单位时间内生成 n mol B,同时消耗 0.5n mol D
C. 容器内压强不随时间而变化
D. 容器内混合气体的密度不随时间而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com