
科目: 来源: 题型:
【题目】合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )

A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. NH3和CH4的中心原子都是sp3杂化
D. SO2和CO2都是直线形分子,其中心原子都是sp杂化
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿是冶炼金属铝的重要原料,其中主要成分为 Al2O3、Fe2O3 等。工业上可 NaOH 溶解 Al2O3 使 其与杂质分离:Al2O3+2NaOH═2NaAlO2+H2O
(1)找出上述反应中化合价为负值的元素,写出其原子的电子式_____。
(2)同温同压下,上述元素形成的气体密度最大的物质的分子式为_____。
(3)上述反应中两种金属元素对应单质的活泼性强弱关系为:____,从原子结构的角度分 析其原因:_________。
(4)若根据化学性质进行物质分类,则 Al2O3 属于______氧化物,据此推测下列反应方程式正确的是______。
A.Al2O3+3H2O═2Al(OH)3
B.2Al(OH)3+3H2SO4═Al2(SO4)3+3H2O
C.Al(OH)3+NaOH═NaA1O2+2H2O
D NaAlO2+4HCl═AlCl3+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A. H2S B. CO2 C.COS D.N2
②在620 K重复实验,平衡后水的物质的量分数为0.03,该反应的ΔH________0(填“>”“<”或“=”)。
③H2S的平衡转化率α1=_____%,反应平衡常数K=______。(第③小题要写计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室向 0.783g MnO2 中加入 20mL36.5%(ρ=1.18g/cm3 )浓盐酸后,共热制取 Cl2.反应方程式为:MnO2+4HClMnCl2+Cl2+2H2O,若反应后溶液体积仍为 20mL,则下列说法正确的是( )
A.反应消耗 HCl 物质的量为 0.236mol
B.反应生成 Cl2 气体的体积为 201.6mL
C.若取 2mL 反应后的溶液,加入足量 AgNO3,可产生沉淀 2.87g
D.若取 2mL 反应后的溶液,加入 2.0mol/L 的 NaOH,当沉淀达到最大值时,消耗 NaOH 溶液的体积为10.9mL
查看答案和解析>>
科目: 来源: 题型:
【题目】如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0。当反应进行到时间 t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。 试回答:
2SO3(g);△H<0。当反应进行到时间 t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。 试回答:

(1)t0时SO3的物质的量为:____________,在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线____________;
(2)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t3时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量________2.1 mol(填“<”、“>”或“=”)。
(3)如图1所示,若起始时在容器中加入0.6 mol SO2、0.3 mol O2 ,保持温度不变,达到平衡状态后,SO3气体的体积分数与上述平衡相比__________(填“<”、“>”或“=”)。。
(4)V2O5是上述反应的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式________,_______;
查看答案和解析>>
科目: 来源: 题型:
【题目】下图甲是一种在微生物作用下将废水中的尿素CO(NH2)2转化为环境友好物质,实现化学能转化为电能的装置,并利用甲、乙两装置实现在铁上镀铜。下列说法中不正确的是

A. 乙装置中溶液颜色不变
B. 铜电极应与Y相连接
C. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铜电极质量减少16g
查看答案和解析>>
科目: 来源: 题型:
【题目】卤代烃R—CH2—CH2—X中的化学键如下图所示,则下列说法正确的是
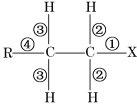
A. 当该卤代烃发生水解反应时,被破坏的键是①和②
B. 当该卤代烃发生消去反应时,被破坏的键是①和③
C. 当该卤代烃发生取代反应时,被破坏的键是①
D. 当该卤代烃发生消去反应时,被破坏的键是①和②
查看答案和解析>>
科目: 来源: 题型:
【题目】含有N、P、Fe、Ti等元素的新型材料有着广泛的用途。
(1)基态Fe原子未成对电子数为______个;基态Ti原子的价电子排布图是_____________。
(2)意大利罗马大学的:FuNvio Cacace等人获得了极具理论研究意义的N4分子,其中氮原子的轨道杂化形式为__________________________。
(3)比较气态氢化物膦(PH3)和氨(NH3)的键角:PH3________NH3(填“大于”、“小于”或“等于”),主要原因为____________________________________________________________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如图所示。

①组成M的元素中,电负性最大的是___________(填名称)。
②M中含有_________(填标号)。
A π键 B σ键
C 离子键 D 配位键

(5)已知金刚石的晶胞沿其体对角线垂直在纸平面上的投影图如下图B所示,则金属铁晶胞沿其体对角线垂直在纸平面上的投影图应该是图__________(填标号)。

(6)某种磁性氮化铁的晶胞结构如图所示,其中距离铁原子最近的铁原子的个数为____________,氮化铁晶胞底边长为a cm,高为c cm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com