
科目: 来源: 题型:
【题目】已知![]() 、
、![]() 、Z-、W2四种离子均具有相同的电子层结构
、Z-、W2四种离子均具有相同的电子层结构![]() 下列关于X、Y、Z、W四种元素的描述,不正确的是
下列关于X、Y、Z、W四种元素的描述,不正确的是![]()
![]()
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y>W2->Z-
查看答案和解析>>
科目: 来源: 题型:
【题目】光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:

据此,下列判断中正确的是( )
A.该溶液中存在着SO2分子
B.该溶液中H+浓度是SO32-浓度的2倍
C.向该溶液中加入足量的酸都能放出SO2气体
D.向该溶液中加入过量NaOH可得到Na2SO3、NaHSO3和NaOH的混合溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】胆矾![]() 是一种重要的含铜化合物,某课外研究小组用粗铜(含少量
是一种重要的含铜化合物,某课外研究小组用粗铜(含少量![]() )通过不同的化学反应制取胆矾的过程如图:
)通过不同的化学反应制取胆矾的过程如图:

物质 | 完全沉淀时的pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
当溶液中被沉淀离子的物质的量浓度小于![]() 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
试回答下列问题:
(1)下列物质中,最适合作为试剂X的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)由粗铜通过两种途径制取胆矾,与途径Ⅱ相比,途径Ⅰ有明显的两个优点,分别是______________、____________________。
(3)试剂Y可以是______________________(任填一种物质的化学式)。
(4)若溶液C中![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() ,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
(5)氢化亚铜![]() 是一种红色固体,40~50℃时,滤液E和
是一种红色固体,40~50℃时,滤液E和![]() 溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5
溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5![]() 个电子,生成CuH的物质的量为________mol。
个电子,生成CuH的物质的量为________mol。
(/span>6)纳米氧化亚铜![]() 是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成
是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成![]() 的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
(7)得到![]() 晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某一元弱酸HA的电离常数![]() 。 向
。 向![]() 浓度约为
浓度约为![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的标准NaOH溶液,其pH变化曲线如图所示
的标准NaOH溶液,其pH变化曲线如图所示![]() 忽略温度变化
忽略温度变化![]() 。请回答下列有关问题:
。请回答下列有关问题:

(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视______________________,滴定终点的现象为_____________________________________________________。
(3)若滴定结束时,滴定管中的液面如图所示,则其读数为___________mL。

(4)滴定过程中部分操作如下,下列各操作使测量结果偏高的是____________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(5)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____![]() 。
。
实验序号 | NaOH溶液体积 | 待测HA溶液体积 |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:①![]()
②2![]()
③![]()
则![]() 的△H=______________。
的△H=______________。
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:![]()
![]() 2
2![]() ,已知该反应在2404℃,平衡常数
,已知该反应在2404℃,平衡常数![]() . 请回答:
. 请回答:
①某温度下,向2L的密闭容器中充入![]() 和
和![]() 各1mol,5分钟后
各1mol,5分钟后![]() 的物质的量为0.5
的物质的量为0.5![]() ,则
,则![]() 的反应速率为________________
的反应速率为________________
②将![]() 、
、![]() 混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____(填字母序号).
混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____(填字母序号).
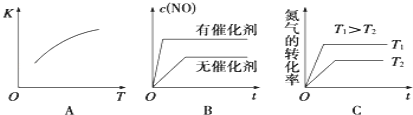
③该温度下,某时刻测得容器内![]() 、
、![]() 、NO的浓度分别为
、NO的浓度分别为![]() 、
、![]() 和
和![]() ,此时反应__________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______________________________.
,此时反应__________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:![]()
![]()
![]()
下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 |
|
|
|
K |
|
|
|
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”).某温度下,将2molCO和6mol![]() 充入2L的密闭容器中,充分反应,达到平衡后,测得
充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
(2)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有![]() 时,实验室利用如图装置模拟该法:
时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ______ .
②请完成电解池中![]() 转化为
转化为![]() 的离子反应方程式:______
的离子反应方程式:______![]() +______
+______ ![]() ______ = ______
______ = ______ ![]() +______
+______![]() ______
______
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______.(已知,
______.(已知,![]() ,
,![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的弱酸,可以被银离子氧化为磷酸。
,具有强还原性的弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____________;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=___________________;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
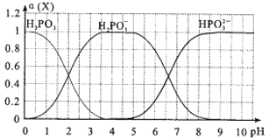
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2X为二元弱酸,常温下,将NaOH溶液加入到H2X溶液中,在不同pH环境下,不同形态的粒子(酸、酸式酸根、酸根离子)的组成分数如图所示。下列说法正确的是

A. HX-的电离程度小于水解程度
B. 在pH=7的溶液中HX-和X2-能大量共存
C. 在pH=9时,H2X 与NaOH恰好完全中和
D. 1L.0.1 molL-1Na2X溶液中,n(HX-)+2n(X2-)+n(H2X)=0.1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为3.92 L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A. 2.80 LB. 3.92 LC. 5.60 LD. 7.84 L
查看答案和解析>>
科目: 来源: 题型:
【题目】结合元素周期表,完成下列问题。

(1)在元素周期表中全部是金属元素的区域为____________(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________,写出其中含有非极性共价键的化合物的电子式_______________。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置__________。
②甲、乙两元素中,金属性较强的是__________(填元素名称),可以验证该结论的实验是_______________(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com