
科目: 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
B. 人体吸入的CO越多,与血红蛋白结合的O2越少
C. CO与HbO2反应的平衡常数K=![]()
D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目: 来源: 题型:
【题目】以Pt-g-C3N4为催化剂,用光催化氧化法脱除NO的过程如图所示。
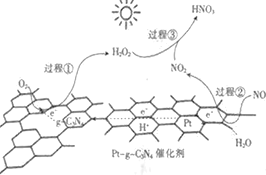
该脱除过程中,下列说法不正确的是
A. 该过程为太阳能转化为化学能
B. Pt端发生的是氧化反应
C. 过程①发生的电极反应为H2O2-2e-=O2↑+2H+
D. 过生③的化学方程式为2NO2+H2O2=2HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容的容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥混合气体总质量⑦混合气体总体积.
A. ①②③④⑤⑥⑦ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是
A. 标准状况下,30.8gCCl4中所含的原子数为NA
B. 100g46%乙醇溶液中含有的H-O键的数目为NA
C. 1molNa2O2与足量的CO2充分反应,转移的电子数为NA
D. n(H2SO3)+n(HSO3-)=1mol的NaHSO3溶液中,含有Na+的数目大于NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
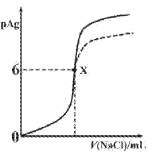
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。

(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:
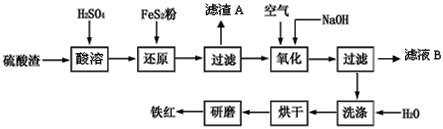
(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
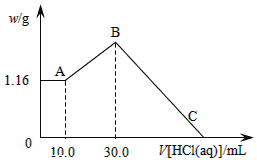
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
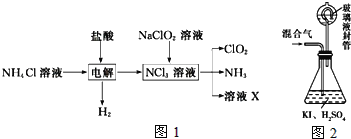
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液中加的溶质可能是( )
A.BaCl2、H2SO4、KClB.CaCl2、HNO3、AgNO3
C.CaCl2、HNO3、NaClD.BaCl2、HCl、Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)某工厂排放出有毒物质NOCl,它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_____。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为____
(二)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:2FeCl3+Cu==2FeCl2+CuCl2。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
①取少量废液,滴加KSCN溶液显红色。
②取100mL废液,加入足量的AgNO3溶液,析出沉淀43.05g。
③另取100mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了2.56g,再向反应后的溶液中滴加KSCN溶液不变色。
根据探究实验得出结论:
(1)废液中含有的金属离子是______。
(2)100mL废液中Cl-的物质的量是______。
(3)原100mL废液中铜离子的物质的量浓度是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com