
科目: 来源: 题型:
【题目】钛酸钡(BaTiO3)主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的配制中。某工厂以重晶石(主要含BaSO4)为原料生产钛酸钡的工艺流程如图:

回答下列问题:
(1)利用焰色反应的原理可定性鉴别某些金属盐。灼烧钛酸钡样品时,钡的焰色为______(填标号)。
A.砖红色 B.黄绿色 C.紫色 D.黄色
(2)用Na2CO3溶液浸泡重晶石(杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K=_________。(已知Kap(BaSO4)=1.2×10-10、Kap(BaCO3)=2.4×10-9)。
(3)流程中“混合”溶液中的钛元素在不同pH时主要以Ti(OH)+、TiOC2O4、TiO(C2O4)23-这三种形式存在(变化曲线如图所示)。实际制备工艺中,先用氨水调节混合溶液的pH在______,再进行“沉淀”,写出该条件下生成草酸氧钛钡晶体的离子方程式:__________。
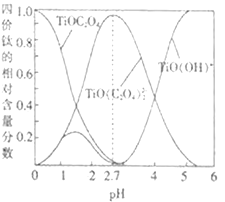
(4)检验草酸氧钛钡晶体是否洗涤干净的操作是_________。
(5)隔绝空气煅烧草酸氧钛钡晶体得到BaTiO3的同时,还能得到气体产物有H2O(g)、________;
(6)BaTiO3成品中C2O42-的含量可以用“氧化还原滴定法”测得。称取m g样品,置于烧杯中,加入50mL0.2 mol·L-1酸性高锰酸钾溶液充分反应后配制成100mL溶液,取20mL该溶液于锥形瓶中用0.1 mol·L-1的硫酸亚铁溶液进行滴定,滴定达到终点的标志是__________,重复滴定3次,平均每次消耗硫酸亚铁溶液的体积为20mL,则BaTiO3成品中C2O42-的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2↑+9H2O,下列说法正确的是( )
2HNO3+4N2↑+9H2O,下列说法正确的是( )
A. 分解反应都是氧化还原反应B. N2是还原产物,HNO3是氧化产物
C. 被氧化与被还原的氮原子数之比为3∶5D. 每生成4mol N2转移15mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】新能源的开发利用是人类社会可持续发展的必然选择。下列不属于新能源开发利用的是
|
|
|
|
A. 风力发电 | B. 锂电池供电 | C. 水力发电 | D. 太阳能供暖 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:

已知:①反应Ⅰ在三颈烧瓶中发生,装置如图所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图;
③Na2SO3·7H2O 和Na2SO3的溶解度曲线如图。
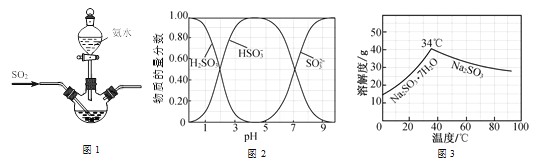
(1)为提高Na2SO3产率,反应Ⅰ应控制pH在_____左右。
(2)反应Ⅱ所得滤液的主要成分是_____和Na2SO3。
(3)将操作Ⅰ后所得的Na2SO3溶液_____(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。
(4)可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(a mol·L-1)至Na2SO3恰好完全氧化成Na2SO4,发生反应3Na2SO3 + KIO3 = 3Na2SO4 + KI,消耗KIO3溶液体积为b mL。通过计算确定样品中Na2SO3的质量分数(写出计算过程)____
(5)滴加酸性KIO3溶液时,剧烈震荡锥形瓶或者滴加时间过长都会造成所测Na2SO3纯度偏低,原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】向NaOH和NaAlO2混合溶液中滴加NaHCO3溶液,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积的变化情况如图所示。下列说法不正确的是
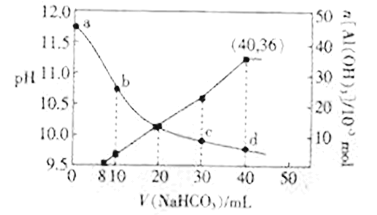
A. 加入的NaHCO3先与NaOH反应
B. b点和c点均有c(Na+)<2c(CO32-)+c(HCO3-)
C. NaHCO3溶液的物质的量浓度为1.125 mol·L-1
D. d点时:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某校回收的含银悬浊废水中含有AgCl、Ag(NH3)2NO3、AgNO3、CH3COONH4、NaCl等,设计从废水中回收硝酸银的具体流程如下:
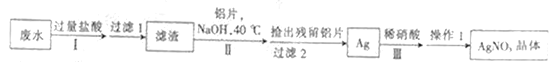
下列说法不正确的是
A. 步骤Ⅱ中发生的主要反应的离子方程:3AgCl+Al+4OH-=3Ag+AlO2-+3Cl-+2H2O
B. 实验中用铝粉代替铝片可以加快反应速率并简化实验操作
C. 步骤Ⅲ中若先将Ag氧化为Ag2O,再加入稀硝酸反应有利于环保
D. 操作Ⅰ包括蒸发浓缩、冷却结晶、过滤、洗涤等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,离子方程式书写正确的是( )
A.向NaHCO3溶液中加入NaOH溶液:HCO3-+OH-=CO2↑+H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH- =2BaSO4↓+AlO2-+2H2O
C.用醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
D.硫酸溶液中滴加足量氢氧化钡溶液:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。例如,
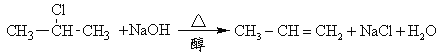
该反应式也可表示为
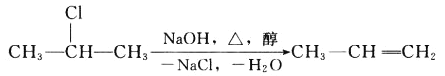
下面是几种有机化合物的转化关系:
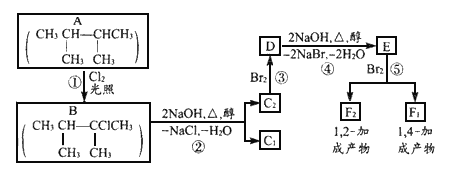
(1)根据系统命名法,化合物A的名称是_____________。
(2)写出下列反应的反应类型,①是_________③是___________。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_________。
(4)C2的结构简式是____________________________,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐的形式存在,可用电解法从溶液中除去。有Cl-存在时。除氮原理如图1所示。主要依靠有效氯(HClO、ClO-)将NH4+或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度与溶液pH的关系如图2所示。
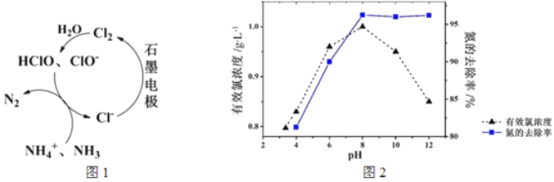
下列说法不正确的是
A. pH=3时,主要发生ClO-氧化NH3的反应
B. pH>8时,有效氯浓度随pH的增大而减小
C. pH>8时,NH4+转变为NH3·H2O,且有利于NH3逸出
D. pH<8时,氮的去除率随pH的减少而下降的原因是c(HClO)减小
查看答案和解析>>
科目: 来源: 题型:
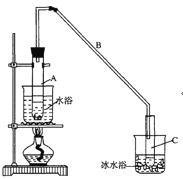
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: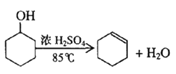

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是___________。
②试管C置于冰水浴中的目的是_____________。
(2)制备精品
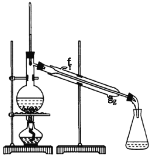
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(_______)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com