
科目: 来源: 题型:
【题目】现有48.4g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150mL某溶液的盐酸中,充分反应后生成CO24.48L(已知算成标准状况下),所得溶液稀释至250mL,测得溶液的c(H+)=0.100mol/L。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=______mol/L
(2)x:y:z=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:
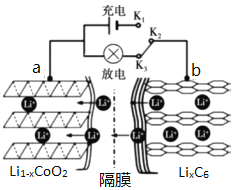
①放电时,电流从______(填“a”或“b”)极流出。
②充电时,a极的电极反应式为______。
(2)钴酸锂回收再生流程如下:
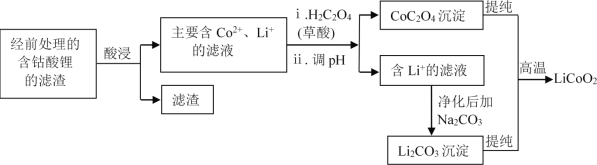
①用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式_______。
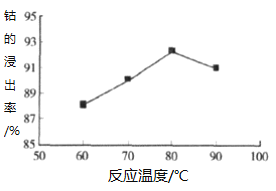
③其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2 混合液中的浸出率曲线如图,请解释温度高于80℃,钴的浸出率变化的原因:______。
④高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)Z在元素周期表中的位置______________。
(2)X的最简单氢化物的电子式为______。
(3)Y单质与NaOH溶液反应的离子方程式为:________。工业生产Y单质的化学方程式为__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
(II)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
(CO中的化学键) | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(5)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】吸烟有害健康,青少年应远离烟草。烟草和烟气中含有多种有害有毒物质,其中剧毒物尼古丁的结构简式如图乙所示,致癌物质苯并吡的结构如图甲所示,有关其叙述正确的是
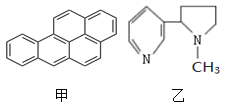
A. 尼古丁属于芳香族化合物
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 苯并吡的分子式为C20H12
D. 苯并吡能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用加热高锰酸钾的方法制取少量氧气。
(1)现在欲制取标准状况下1.12L氧气,需要消耗高锰酸钾________g;
(2)反应产生的MnO2经分离出来,与足量浓盐酸反应,其中被氧化的HCl的物质的量是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述错误的是
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若电子转移的数目为5NA,则有212克氯气生成
B. 常温常压下,40g氖气所含的分子数目为2NA
C. 含2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目: 来源: 题型:
【题目】医院处方药“复方电解质注射液”可作为水、电解质的补充源,注射液中含有NaCl、MgCl2和KCl三种无机盐,其中![]() 。
。
(1)若实验室药配制该电解质注射液500mL,所需的玻璃仪器有:玻璃板、烧杯和_______,需用托盘天平称量氯化钠固体___________g;
(2)已知该注射液中![]() ,
,![]() ,则
,则![]() ________
________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工水平的标志,乙烯有如下转化关系。
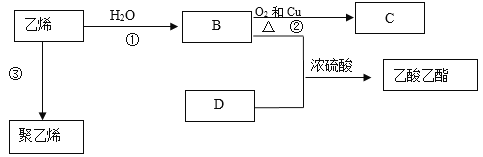
请回答下列问题:
(1)乙烯的结构简式为______。
(2)B所含官能团的名称为____________。
(3)③的反应类型是____________。
(4)浓硫酸的作用是________________。
(5)反应①的化学方程式为________________________________________________。
反应②的化学方程式为_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com