
科目: 来源: 题型:
【题目】利用双离子交换膜电解法可以处理含NH4NO3的工业废水,原理如图所示,下列叙述错误的是
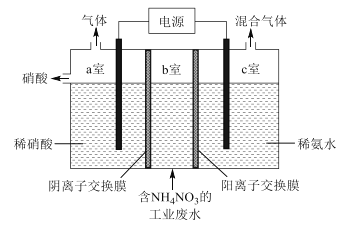
A. NH4+由b室向c室迁移
B. c室得到的混合气体是NH3和H2
C. 阳极反应式为2H2O -4e-=O2+4H+
D. 理论上外电路中流过1mol电子,可处理工业废水中0.5mol NH4NO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
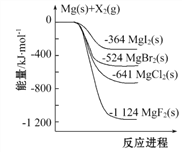
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。已知2NO+O2==2NO2,打开活塞,使NO与O2充分反应,则下列说法正确的是
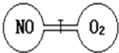
A. 开始时左右两室分子数相同B. 反应开始后NO室压强增大
C. 最终容器内密度与原来相同D. 最终容器内仍然有NO剩余
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y原子核外电子有6种不同的运动状态;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K的+1价阳离子的核外有3层电子且各层均处于全满状态;L位于ds区,它的基态原子的N层上只有2个电子。
请回答下列问题:(答题时,X、Y、Z、W、K、L用所对应的元素符号表示)
(1)ZX5为离子化合物,写出它的电子式_________________。
(2) K的基态原子的电子排布式是______________________。
(3) Y、Z、W元素的第一电离能由大到小的顺序是__________________。
(4)第一电离能I1(L)__I1(K)(填“大于”或“小于”),原因是________________
(5)Y2X4是石油炼制的重要产物之一, 1mol Y2X4分子中含σ键为______mol;
(6)肼(Z2H4)可用作火箭燃料,其原理是:Z2O4(l)+2Z2H4(l)=3Z2(g)+4H2O(g),若反应中有4mol Z-H键断裂,则形成的π键有_________mol.
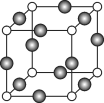
(7)Z、K两元素形成的某化合物的晶胞结构如图所示,则Z原子的配位数是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L气体所含的分子数一定大于11.2L气体所含的分子数
B.常温常压下, 由O3与O2组成的混合气体48g含有的原子数为3NA
C.标准状况下,33.6L 四氯化碳(CCl4)中含有的碳原子数目为1.5NA
D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】依据下列方程式得出的结论不正确的是
A. C(石墨,s)=C(金刚石,s) △H>0,说明石墨比金刚石稳定
B. NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强
C. 2HCl+CaCO3=CaCl2+CO2↑+H2O,说明盐酸是强酸
D. CH3COO-+H2O![]() CH3COOH+OH-,说明CH3COOH是弱电解质
CH3COOH+OH-,说明CH3COOH是弱电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
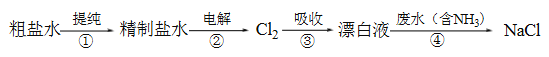
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】许多金属及其化合物在生活、化工、医药、材料等各个领域有着广泛的应用。
(1)钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。钛基态原子中电子占据最高能级的符号为________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_______种。钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是___________________。
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
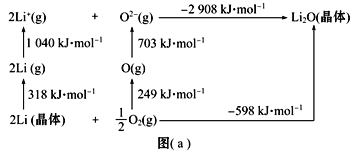
Li原子的第一电离能为______kJ·mol-1,O![]() O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】环与环之间共用两个或多个碳原子的多环烷烃称为桥环烷烃,其中二环[1.1.0]丁烷 (![]() )是其中一种。下列关于该化合物的说法正确的是
)是其中一种。下列关于该化合物的说法正确的是
A. 与C3H4是同系物
B. 一氯代物只有一种
C. 与环丁烯互为同分异构体
D. 所有碳原子可能都处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com