
科目: 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是实验室制乙烯并检验其性质的装置图,请回答:

(1)写出圆底烧瓶中反应的方程式______________________________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:____________________________________________;
(3)为了检验乙烯的生成及乙烯的不饱和性,试管中应盛放_________,现象为___________;
(4)洗瓶中盛放的试剂为____________________,作用__________________.
查看答案和解析>>
科目: 来源: 题型:
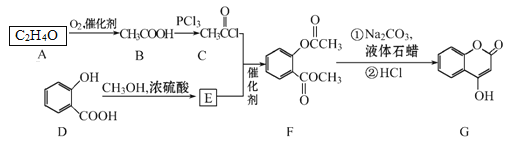
【题目】有机化合物G可用来制备抗凝血药,可通过下列路线合成。
请回答:
(1)C+E→F的反应类型是____。
(2)F中含有的官能团名称为____。
(3)在A→B的反应中,检验A是否反应完全的试剂为_____。
(4)写出G和过量NaOH溶液共热时反应的化学方程式_____。
(5)化合物E的同分异构体很多,符合下列条件的结构共____种。
①能与氯化铁溶液发生显色;②能发生银镜反应;③能发生水解反应
其中,核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的结构简式为___。
(6)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验.
(1)(分子式的确定)
①将4.6 g有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,质谱仪测定该有机化合物的相对分子质量为46,则该有机物的分子式是__________;
②根据价键理论,预测A的所有可能结构并写出结构简式_____________,_____________。
(2)(结构式的确定)经测定,有机物A的核磁共振氢谱示意图如图,则A的结构简式为______________

(3)(性质实验)
① A在一定条件下脱水可生成B,B可发生加聚反应合成包装塑料C,请写出B转化为C的化学反应方程式:__________________________________________________.
②体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:__________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。

查看答案和解析>>
科目: 来源: 题型:
【题目】As和P属于同主族元素,它们都能形成多种含氧酸。中国自古就有“信口雌黄”“雄黄入药”之说。雌黄(As2S3)和雄黄(As4S4)早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。在一定条件下,雌黄和雄黄的转化关系如图所示。

(1)亚磷酸(H3PO3)是一种精细化工产品。亚磷酸(H3PO3)与足量NaOH溶液反应生成Na2HPO3。
①则亚磷酸为___(填“一”“二”或“三”)元酸。
②查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7,Na2HPO3可使碘水褪色,25℃时,Na2HPO3水解反应的Kh=____,若向Na2HPO3溶液中加入少量的I2,则溶液中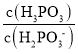 将__(填“增大”、“减小”或“不变”)
将__(填“增大”、“减小”或“不变”)
(2)反应II中,若0.5molAs4S4参加反应,转移14 mol电子,则物质a为__(填化学式)
(3)反应Ⅲ中的产物亚砷酸H3AsO3可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。
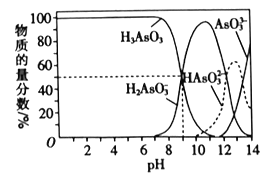
以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
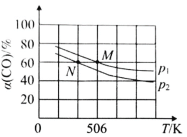
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图,回答问题。
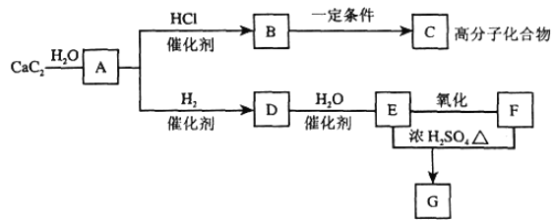
(1)有机物的结构简式:C._________________, E_______________。
(2)①反应DE的化学方程式是___________________________________________。
②E和F反应生成G的化学方程式是_______________,反应类型为__________。
③实验室制取A的化学方程式__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物(NOx)是大气污染物之一。工业上在一定的温度和催化剂条件下,可用NH3来消除NOx的污染,生成两种对环境无害的物质。
(1)请写出NH3与NO2反应的化学方程式____。
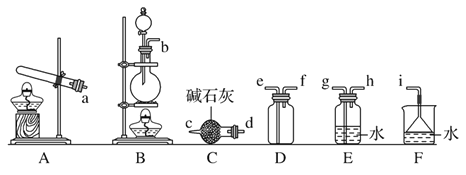
(2)①写出实验室中由固体物质制取氨气的化学方程式__;
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)
(3)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。

①写出电解时NO2发生反应的电极反应式:___。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com