
科目: 来源: 题型:
【题目】下面所示是实验室制取SO2,并验证SO2的某些性质的装置图。试回答:
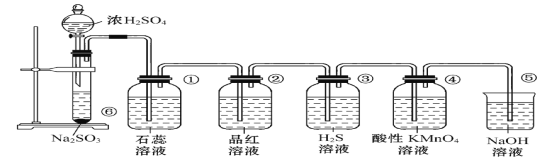
(1)②可证明SO2有___性;③可证明SO2有___性。
(2)④中的实验现象是__,证明SO2有___性。
(3)⑤的作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Fe3+=Cu2++2Fe2+”设计一个原电池(正极材料用碳棒),回答下列问题:
该电池的负极材料是___,发生___反应(填“氧化”或“还原”);电解质溶液是___;若导线上转移电子1mol,则被氧化的物质___克。
(2)已知拆开1molH—H键、1molN≡N分别需要吸收的能量为akJ、bkJ,形成1molN—H键需要释放ckJ能量。且已知N2和H2合成NH3的反应是放热反应,则生成1molNH3需要放出___的热量。
(3)铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入6mol·L-1NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是___mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列各组物质中:A.O2和O3 B.12C和13C C.H2O和D2O
___组两物质互为同位素;___组两物质互为同素异形体。
(2)工业上用![]() 做原料制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
做原料制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
第一步反应:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
第二步反应:___;
第三步反应:___。
(3)把下列现象中硫酸所表现出来的性质填写在空白处。
用稀硫酸清洗铁锈___;
放置在敞口烧杯中的浓硫酸质量增加__;
浓硫酸滴在纸上时,纸变黑。__;
把铜片放入热的浓硫酸中时,有气体放出。___。
(4)用序号填空,下列物质中:①PH3 ②H2O2 ③Na2O2 ④KOH ⑤(NH4)2SO4 ⑥F2
只含共价键的是___;既含离子键又含极性键的是___;既含离子键又含非极性键的是___。
(5)下列反应中,属于放热反应的有___(填序号)。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)
②Ba(OH)2·8H2O和NH4Cl晶体的反应
③炸药爆炸
④酸与碱的中和反应
⑤生石灰与水作用制熟石灰
⑥食物因氧化而腐败
⑦乙醇燃烧
查看答案和解析>>
科目: 来源: 题型:
【题目】将14g铜银合金与足量的HNO3反应,放出的气体与标准状况下体积为1.12L的O2 混合后再通入水中,恰好全部吸收,则合金中铜的质量为
A. 4.8g B. 3.2g C. 6.4g D. 10.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】将足量X气体通入Y溶液中,实验结果与预测现象一致的组合是( )
X气体 | Y溶液 | 预测现象 |
| |
① | CO2 | Na2SiO3溶液 | 有白色沉淀产生 | |
② | SO2 | BaCl2溶液 | 有白色沉淀产生 | |
③ | Cl2 | AgNO3溶液 | 有白色沉淀产生 | |
④ | NH3 | AlCl3溶液 | 有白色沉淀产生 |
A.只有①②③B.只有①②④
C.只有①③④D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学一选修3:物质结构与性质]太阳能电池板材料除单品硅外,还有含铜、铟、镓、硒等元素的化学物质。
(1)基态硅原子的价电子轨道表达式__________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取________杂化方式,硅烷的沸点与相对分子质量的关系如下图所示现这种变化的原因是_________。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为____________(用元素符号表示)。
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种阴离子为_______(填化学式)。
(5)CuCl的盐酸溶液吸收CO形成氯化羰基亚铜[CuCl(CO)2 H2O,通常形成二聚体,结构示意图如下。则该化合物中与Cu+形成配位键的原子是_________。

(6)—种铜金合金晶体具有面心立方最密堆枳结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为____________,若该晶体的晶胞棱长为a nm,则该合金密度为____________(列出计算式,不要求计算结果,阿伏加徳罗常数的值为NA)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
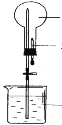
A.a为HCl,b为H2O
B.a为SO2,b为浓NaOH溶液
C.a为NH3,b为稀盐酸
D.a为Cl2,b为饱和NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为____________,形成该分散系的微粒直径范围是_________。
(3)电子工业需用30%FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式_________。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气、②铁粉、③浓硝酸、④浓盐酸、⑤烧碱、⑥浓氨水,需用用到的一组试剂是__________。
A. ①②④ B. ①③④⑥ C. ②④⑤ D. ①④⑥
(4)高铁酸钠Na2FeO3是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为__________。
②高铁酸钠在水中可以发生如下反应:FeO42-+10H2O=4Fe(OH)3+8OH-+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有_____性,而能够除去水中悬浮物是因为________。
③下列物质能作净水削的有_________。
a.KAl(SO4)2·12H2O b.聚合硫酸铁[Fe(OH)(SO4)]n c.ClO2 d.“84消毒液”
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列说法正确的是( )

A. 正极的电极反应式为2H++2e-===H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com