
科目: 来源: 题型:
【题目】有关如图装置的叙述正确的是

A.电子由Pt流向Fe
B.这是电解NaOH溶液的装置
C.该装置中Fe为阴极,电极反应为:Fe-2e-+2OH-=Fe(OH)2
D.该装置中Pt为正极,电极反应为:O2 + 2H2O + 4e-=4OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)![]() 2HI(g);△H=-9.48 kJ·mol-1
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g)![]() 2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.反应(i)的产物比反应(ii)的产物稳定
C.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目: 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
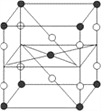
A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解AgNO3溶液,说法不正确的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钠元素、钴元素在工业上有重要的应用。请回答下列问题:
(1)Ca大于Co的是________(填标号)
A. 最外层电子数 B. 原子半径
C. 第一电离能 D. 未成对电子数
(2)经X射线衍射法测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下的晶胞参数为a cm,则钴原子的半径为______pm。
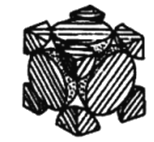
(3)Co3+氧化性极强,在水溶液中易被还原成Co2+,而在氨水中可稳定存在,其原因是________。
(4)已知:配合物中,配位体中含有一个配位原子的配体称为单齿配体;一个配体中有两个或两个以上配位原子的配体称为多齿配体。[Co(NO3—)4]2—中Co2+的配位数为4,该配离子中各元素第一电离能由大到小的顺序_______(填元素符号),1mol该离子中含σ键数目为_________。
(5)①Co的某配合物化学式为CoCl3·3NH3,为八面体结构,其中极性分子有___种。
②该配合物在热NaOH溶液中发生反应产生沉淀,并释放出气体,该反应的化学方程式_________。
(6)NaCl晶体在50~300GPa的高压下和Cl2反应,可以形成一种新晶体,其立方晶胞如下图所示(大球为Cl,小球为Na)。
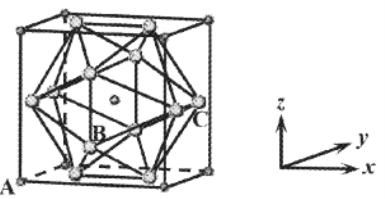
①若A的原子坐标为(0,0,0),C的原子坐标为(1,![]() ,
,![]() ),则B的原子坐标为________。
),则B的原子坐标为________。
②晶体中,Cl构成的多面体包含_____个三角形的面,与Cl紧邻的Na个数为______。
(7)钴蓝晶体结构如下图,该立方晶胞由I型和II型小立方体各4个构成,其化学式为_____,晶体中Al3+占据O2—形成的_____面体空隙,NA为阿伏伽德罗常数的值,设化学式对应的摩尔质量为Mg/mol,则钴蓝晶体的密度计算式为_________g/cm3。

查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
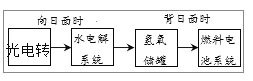
A.该能量转化系统中的水也是可以循环的
B.燃料电池放电时的负极电极反应式:2H2+4OH--4e-=4H2O
C.燃料电池放电时的正极电极反应式:2H2O+O2+4e-=4OH-
D.燃料电池系统产生的能量实际上来自于水
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列说法正确的是( )
A.在1000s内,反应吸收的热量为2.5Q kJ
B.在500s内,O2分解速率为3×10-3 mol·L-1·s-1
C.在1000s时,反应恰好达到平衡
D.在1500s时,N2O5的正反应速率等于NO2的逆反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素(不包含0族元素)。J的原子半径是周期表所有元素中最小的,M基态原子的3个能级所含电子数相同,R的基态原子2p能级上未成对电子数与M相同,T的基态原子含13种运动状态不同的电子,X与R位于同一主族,Y的基态原子最外层有7个电子,Z的基态原子最外层电子数是次外层的1/7。(回答问题时用字母对应的元素符号)

⑴基态Z2+的核外电子排布式是______。
⑵Q、R、X的第一电离能由大到小的顺序是______。
⑶X8的结构如图甲所示,其熔沸点均高于XR2,原因是______。
⑷气态XR3以单分子形式存在,其分子的立体构型为______;固体XR3中存在如图乙所示的三聚分子,该分子中X原子的杂化轨道类型为______。
⑸不考虑配离子[T(RJ)4]-的空间构型, [T(RJ)4]-的结构式可以表示为______。(用“→”表示其中的配位键)
⑹由T、Q原子形成的晶体晶胞如图丙所示,相邻T、Q原子间以共价键相连接。该晶体的化学式为______,预测该晶体熔点高或低,并说明理由:_____。
⑺ZX2晶体的晶胞如图丁所示,距离每个Z2+最近的Z2+的个数是______。
⑻JY易溶于水的原因是______。
⑼1 mol MR(QJ2)2中所含σ键的数目是______。
⑽MQR-的中心原子的轨道杂化类型是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷、硫、氯元素在科研与生产中也有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式________ 。
(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为___________。但NCl5不存在,其原因是___________________。
(3)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式_______________________。
(4)①请推测①HC1O4、②H5IO6[可写成(HO)5IO]、③HIO4三种物质的酸性由强到弱的顺序为_________(填序号)。
②已知一定条件下发生反应:Na2O+NaCl=Na3OCl,该反应过程中破坏和形成的化学键有_________。
(5)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:____;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为_____。

(6)多原子分子中各原子若在同一平面,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键。分子中的π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】杀灭菊酯是一种高效低毒农药,一种合成杀灭菊酯的路线如下:
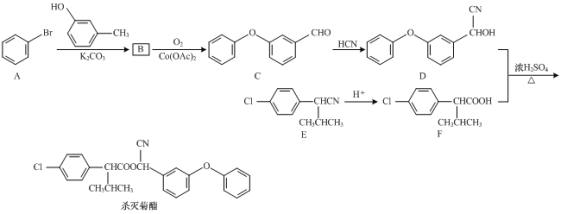
⑴C中含氧官能团的名称为______和______。
⑵B的分子式为C13H12O,则B的结构简式为______。
⑶B→C的反应类型为______。
⑷任写出一种符合下列要求的化合物C的同分异构体的结构简式:______。
Ⅰ既能发生银镜反应,也能发生水解反应,酸性条件下所得水解产物之一核磁共振氢谱中有6个峰;Ⅱ分子中含有2个苯环。
⑸写出以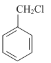 为原料制备
为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com