
科目: 来源: 题型:
【题目】一定温度下在容积不变的密闭容器中进行如下可逆反应:
SiF4(g)+2H2O(g)SiO2(s)+4HF(g),下列能表明该反应已达到化学平衡状态的是
①v正(SiF4)=4v逆(HF)②HF的体积分数不再变化③容器内气体压强不再变化
④混合气体的密度保持不变⑤4molO—H键断裂的同时,有2molH—F键断裂
A.①②③④B.②③④C.②⑤D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】向一密闭容器中放入1molX,进行可逆反应2X(g)3Y(g),反应过程中的反应速率(v)与时间(t)的关系曲线如图所示,下列叙述正确的是

A.t1时,只有正反应
B.t2~t3时,反应不再发生
C.t2时,容器内有1.5molY
D.t2~t3时,X、Y的物质的量均没有发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。
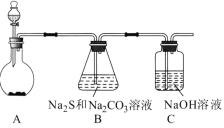
(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
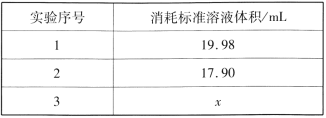
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)硫酸镍溶于过量的氨水可形成[Ni(NH3)6]SO4溶液。
①[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_____,中心原子(离子)是____;
②SO42-中,中心原子的轨道杂化类型为_______;
③写出一种与SO42-互为等电子体的分子的化学式______;
(2)NH3极易溶于水,除因为它们都是极性分子外,还因为__________。
(3)已知H—H键能为436kJ/mol,N≡N键的键能为945kJ/mol,根据化学方程式:N2+3H2 ==2NH3 ΔH=-92.4kJ/mol,则H—N键能为____kJ/mol。
(4)下列分子既存在p-sp σ键,也存在p-p π键的是_____。
A.NH3 B.H2 C.CO2 D.C2H2
(5)根据已经掌握的共价键知识判断,键的极性N—H___O—H(“>”,“=”或“<”)
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应2A(g)+3B(g)![]() 4C(g),下列各数据表示不同条件下的化学反应速率,其中反应进行得最快的是
4C(g),下列各数据表示不同条件下的化学反应速率,其中反应进行得最快的是
A.υ(C)=3.6mol/(L·min)B.υ(B)=0.04mol/(L·s)
C.υ(B)=0.9mol/(L·min)D.υ(A)=1.6mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系.A的产量是衡量一个国家石油化工生产水平的标志;D能使石蕊试液变红;E是不溶于水且具有水果香味的无色液体,相对分子质量是C的2倍;F是塑料的主要成分之一,常用于制食品包装袋。结合如图关系回答问题:

(1)按要求回答下列问题:
①写出A、E的结构简式:A___、E___;
②写出B、C、D中官能团的名称:B___、C___、D___;
③写出反应②的反应方程式:___。
(2)A与苯都是石油化工的重要产品,在一定条件下A可以转化生成苯,按要求回答下列问题:
①苯可以发生取代反应,写出由苯制备溴苯的化学反应方程式:___。
②纯净的溴苯是无色油状液体,实验室制得的粗溴苯通常因溶解了Br2呈褐色,可以加入试剂___除去,该除杂操作所必须的主要玻璃仪器是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.双氰胺结构简式如图。
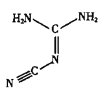
(1)双氰胺的晶体类型为_____。
(2)双氰胺所含元素中,_____(填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_____
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4
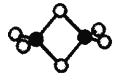
(4)乙硼烷分子中硼原子的杂化轨道类型为______。
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为____(填序号)。
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为____(填元素符号)。
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
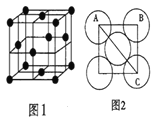
(7)晶体铝中原子的堆积方式为_____。
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=___g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
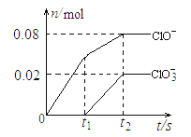
A.苛性钾溶液中KOH的质量是15.68 g
B.反应中ClO3-的生成是因为Cl2通入过量
C.在酸性条件下 ClO- 和ClO3-可生成Cl2
D.一定有3.136 L氯气参与反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com