
科目: 来源: 题型:
【题目】以含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料的碳一化学处于未来化学产业的核心,成为科学家研究的重要课题。
(1))已知CO、H2、CH3OH(g)的燃烧热分别为-283.0 kJ·mol-1、-285.8 kJ·mol-1、-764.5 kJ·mol-1。则反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH=_____;。
CH3OH(g) ΔH=_____;。
(2)在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。
CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2时,经过5 min达到平衡,CO的转化率为0.6,则0~5 min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4 mol,达到新平衡时H2的转化率将____(填“增大”“减小”或“不变”)。
②当n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为________。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_____L。
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的负极为__(填“A”或“B”),写出阳极的电极反应式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法错误的是
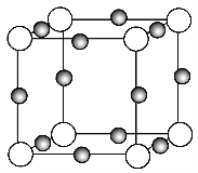
A. X元素的原子序数是19 B. X的晶体具有良好的导电性、导热性和延展性
C. X+离子是图中的黑球 D. 该晶体中阳离子与阴离子个数比为3∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是
A. 甲、乙、丙三种物质都含有氮元素 B. 反应Ⅱ、Ⅲ和Ⅳ的氧化剂相同
C. Ⅵ的产物可在上述流程中被再次利用 D. 丁为NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室中某些气体的制备、除杂、收集装置。用此装置能获得干燥纯净气体的是
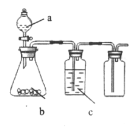
选项 | a | b | c | 气体 |
A | 浓盐酸 | Na2SO3 | 浓硫酸 | SO2 |
B | 稀硝酸 | Cu | 浓硫酸 | NO |
C | 浓盐酸 | MnO2 | 饱和食盐水 | Cl2 |
D | H2O2 | MnO2 | 浓硫酸 | O2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分子或离子中键角由大到小排列的是
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
A. ⑤④①②③ B. ④①②⑤③ C. ⑤①④②③ D. ③②④①⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是__________________________(写一点);浸取铬时反应的离子方程式为_______________。
(2)步骤Ⅱ滤渣返回再次浸取的目的是_____________________________________________。
(3)步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图1所示:

图1 图2
pH小于2.3时,铁去除率低,其原因是_______________________________________。
(4)步骤Ⅳ能说明沉淀已洗涤干净的操作是________________________________________。
(5)步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为_____________________________;沉铬时,溶液pH与铬的回收率关系如图2所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com