
科目: 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[![]() ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____________________________;CaCN2中阴离子为CN![]() ,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________,Ca2+采取的堆积方式为____________________________,每个Ca2+周围距离最近且相等的Ca2+有________个。
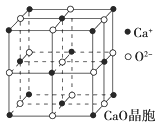
(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=______________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】有以下物质①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩液态氯化氢。
(1)其中能导电的是_______;属于非电解质的是_________。
(2)等质量④和⑤中氢原子的数目之比为_____;若④和⑤中所含氢原子数相等,则④和⑤的质量之比为________。
(3)写出⑥和⑧在水溶液中的离子反应方程式____________________________。
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。
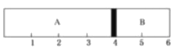
①A室混合气体所含分子总数约为______________(填数值)
②实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压下氢气密度的______倍。
③若将A室H2、O2的混合气体点燃,恢复原温度后,最终活塞停留的位置在______刻度处。
(5)在标准状况下,1L2mol/L氢氧化钠溶液中通入33.6L二氧化碳气体充分反应,所得溶液溶质的成分是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中碘含量比较高,从海带提取碘的操作如下:
(1)将干海带进行灼烧的仪器是________,海带灰中含有较多KI,将海带灰溶于水,然后过滤得到澄清滤液。
(2)向上述滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。请写出离子反应方程式:________________________________。
(3)向上述碘的水溶液中加入适量CCl4,振荡,静置,则I2会转入到CCl4层中,这个过程叫_____________________,现象为____________________________。
(4)3I2+6KOH=5KI+KIO3+3H2O;1.5mol I2完全反应转移电子的物质的量为_____mol;氧化剂与还原剂的物质的量之比为___________。
(5)某一反应体系有反应物和生成物共6种物质:O2、K2Cr2O7、Cr2(SO4)3、H2SO4、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中,氧化剂为____________。氧化产物为____________。
②写出该反应的化学方程式__________________________。
③用单线桥法表示上述反应中电子转移方向和数目________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、(1)在25 ℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:___________________________________。
(2)Zn(s) + 1/2 O2(g) = ZnO(s) ΔH1 = -351 kJ/mol Hg(l) + 1/2 O2(g) = HgO(s) ΔH2 = -91 kJ/mol,由此可知ZnO(s) + Hg(l) = Zn(s) + HgO(s) △H3= __________kJ/mol。
Ⅱ、二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,总反应为:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡。改变下列条件之一,既能提高反应速率,又能提高CO的转化率的是________(填字母代号)。
a 降低温度 b 加入催化剂 c 缩小容器体积 d 增加H2的浓度
(2)该反应的化学平衡常数表达式K = _______________________,升高温度,平衡常数___________(填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3 H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
① 反应开始时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”)
② 平衡时,n(CH3OCH3) = ________,平衡时CO2的转化率为________。
③ 平衡时,再向原容器中投入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,一段时间后达到新的平衡,此时CO2的转化率与原平衡相比________(填“增大”、 “减小”或 “不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
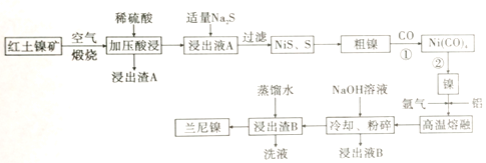
(1)煅烧时生成的主要气体产物是________ ,浸出渣A的主要成分是________。
(2)红土镍矿煅烧后生成的Ni2O3有强氧化性,加压酸浸时有无色无味的气体产生且有NiSO4生成,则该反应中氧化产物与还原产物的物质的量之比为________。
(3)向浸出液A中加入适量Na2S,发生氧化还原反应的离子方程式为________。
(4)若Na2S过量,则过滤出的固体中会混有________;H2S也可代替Na2S使用,但不利之处是________。
(5)已知Ni(CO)4的沸点是42.2℃,Ni(s)+CO(g) ![]() Ni(CO)4(g)的平衡常数与温度关系如下:
Ni(CO)4(g)的平衡常数与温度关系如下:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
步骤①、步骤②的最佳温度分别是________、 ________(选填项代号)。
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(6)加氢氧化钠的目的是溶解部分铝,形成多孔结构的镍铝合金,已知红土镍矿中NiS质量分数45.5%,取1kg红土镍矿进行制备,熔融时加入270g铝,浸出时消耗800mL 5mol/LNaOH,理论上生成的兰尼镍的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是
A. 在稀CH3COOH溶液中加入少量CH3COONa固体,醋酸的浓度增大,电离程度减小
B. CH3COOH溶液与Na2CO3溶液反应生成CO2,可以证明CH3COOH是弱酸
C. 0.1 mol AgCl和0.1mol AgI混合后加入1 L水中,所得溶液中c(Cl-) = c(I-)
D. 室温下,pH = 2的盐酸与pH = 12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在工业生产中应用广泛。
Ⅰ.某同学设计如下实验装置测定铜的相对原子质量(夹持和加热仪器已略去),并检验氯气的氧化性。
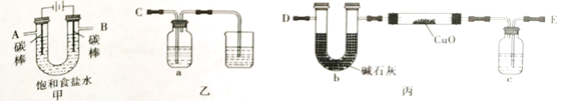
(1)该实验装置的连接顺序为:A连接________,B连接________(填字母)。
(2)乙装置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)对丙装置进行加热前需要________ 。
(4)准确称量 m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为________ (只要求列出算式)。该实验方案的装置有不合理之处,若不加以改正会导致测定结果________(填“偏大”、”偏小“或”不变“)。
Ⅱ.研究发现Cu与稀盐酸不反应,但在持续通入空气的条件下可反应生成CuCl2。
(5)已知Fe3+对该反应有催化作用,其催化原理如图所示:
![]()
则图中的M‘为________(填化学符号)
(6)向CuCl2溶液中通入H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2++H2S=CuS(s)+2H+ , 则该反应的平衡常数K=________(保留一位小数)。已知:CuS溶度积KSP=1.0×10-36 , H2S电离常数Ka1=1.3×10-7 , Ka2=7.0×10-15。
查看答案和解析>>
科目: 来源: 题型:
【题目】用混有硫酸亚铁和硫酸镁等杂质的锰矿(含MnO2、MnCO3)生产硫酸锰,实验室模拟生产过程如下:
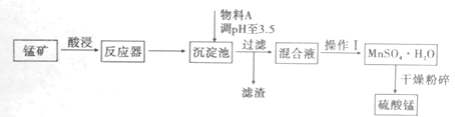
已知金属离子完全沉淀时的pH值如下:Fe3+:3.5;Fe2+:9.5;Mn2+:10.8;Mg2+:11.6。
(1)反应器中发生氧化还原反应的离子方程式是________。
(2)从经济效益考虑,物料A可以是________。
(3)硫酸锰和硫酸镁的溶解度曲线如右图所示:
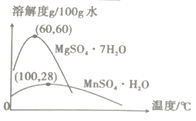
则操作Ⅰ包含的主要操作为________。
(4)MnSO4·H2O在1150℃条件下分解,产物是Mn2O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com