
科目: 来源: 题型:
【题目】(1)现有氧化还原反应:3H2O2 + 2H2CrO4 =2Cr(OH)3 + 3O2 ↑+ 2H2O
①用单线桥标出反应中的电子转移数目和方向_____________;
②其中Cr被___________,H2O2作___________剂;
③反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(2)①将用砂纸打磨过的铝片用坩埚钳夹住在酒精灯上点燃,现象是:________;
②在试管中加入少量Na2O2再加入少量水,用带火星的木条伸入试管,再滴入几滴酚酞,可观察到的现象是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
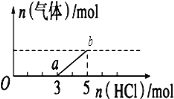
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是( )

A.CH3COOH溶液中滴加KOH溶液
B.NaOH溶液中滴加稀HCl
C.Ba(OH)2溶液中滴加稀H2SO4
D.Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图,回答问题。
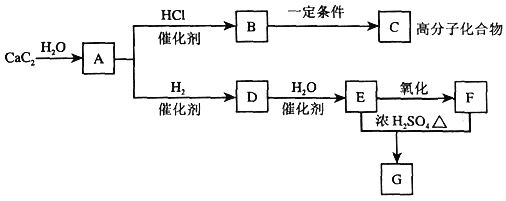
(1)B中所含官能团的名称是:_______。
(2)反应B→C的化学方程式是________;反应D→E的化学方程式是_______。
(3)B→C的反应类型属于______。
(4)写出实验室制取A的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示,实验操作为:预先使棉花团浸透乙醇,并按照图装置好,在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
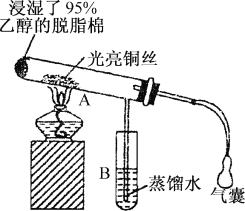
请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为:________。
(2)从A管中可观察到_______的实验现象,从中可认识到在该实验过程中,催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______。
(3)已知醇的氧化反应是放热反应,在实验进行一段时间后,如果只撤掉酒精灯,反应还能否继续进行?______;原受热的铜丝处有什么现象?_______。
(4)验证乙醇氧化产物的化学方法是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
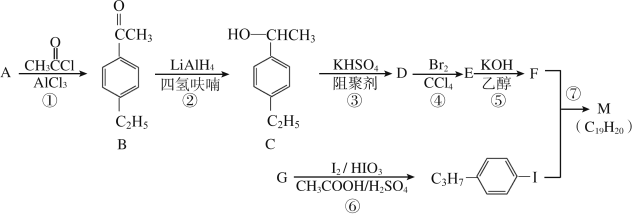
回答下列问题:
(1)A的结构简式为_______。
(2)D分子中最多有_____个碳原子共平面,与D化学式相同且符合下列条件的同分异构体有__种。(①与D具有相同的官能团,②苯环上的三元取代物)
(3)①的反应类型是________。
(4)⑤的化学方程式为________。
(5)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊的主要成分,实验室制取叠氮化钠的实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

(1)装置B中盛放的药品为____。
(2)步骤①中先加热通氨气一段时间的目的是____;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为____。步骤③中最适宜的加热方式为___(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为____。
(4)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质均不参与反应)。
③充分反应后滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+=Ce3++Fe3+)。计算可知叠氮化钠的质量分数为____(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是____(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(5)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是____(用元素符号表示)。
(3)上述深蓝色晶体中含有的元素的电负性最小的是____(用元素符号表示)。
(4)H2O的中心原子轨道杂化类型为____杂化;SO42-离子的立体构型是____,写出与SO42-互为等电子体的一种离子____。
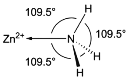
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____。
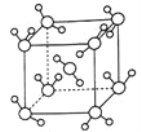
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为____g.cm-3(只列式,不计算)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。该有机物的分子式为______。
Ⅱ.为了证明溴乙烷中存在溴原子,某同学设计如下实验:
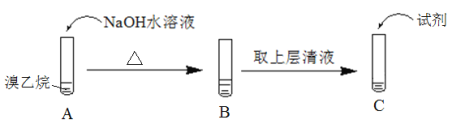
①将试管C中加入的试剂及相应的实验现象补充完整:_________。
②溴乙烷在NaOH水溶液中反应的化学方程式是_____________。
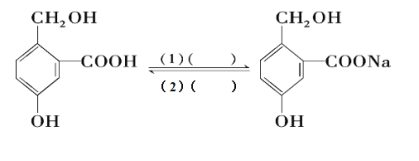
Ⅲ.为实现以下各步转化,请在下列括号中填入适当试剂。______、______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com