
科目: 来源: 题型:
【题目】下表为元素周期表一部分,针对表中①~⑥元素,回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
(1)①元素在周期表中的位置是第二周期 ________ 族。
(2)②和⑤两种元素中原子半径较大的是 _________(填元素符号)。③和④两种元素的最高价氧化物对应水化物中碱性较强的是___(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式书写正确的是
A. 水溶液中NaHCO3电离:NaHCO3 = Na++H++CO32-
B. H2SO3电离:H2SO3![]() 2H++SO32-
2H++SO32-
C. HClO电离:HClO![]() H++ClO-
H++ClO-
D. 水溶液中NaHSO4电离:NaHSO4 = Na++HSO4-
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应a A(g)+b B(s)![]() c C(g)+d D(g)达平衡后,保持温度不变,将容器缩小为原来的一半,达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是
c C(g)+d D(g)达平衡后,保持温度不变,将容器缩小为原来的一半,达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是
A. 平衡向逆反应方向移动B. a<c+d
C. 物质A的转化率增大D. 物质D的浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】体积一定的密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
A. 平衡后若继续充入X,平衡正向移动,Y的转化率增大
B. 平衡后若升高体系温度,平衡逆向移动,Z的体积分数减小
C. 平衡后若移走部分W,平衡正向移动
D. 平衡后若移走部分X,上述反应的ΔH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。

查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不再变化时 ②容器内气体的压强不再变化时 ③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时 ⑤混合气体的平均相对分子质量不再变化时 ⑥v正(B)=2v逆(C)时
A. ①④⑤⑥B. ②③⑥C. ②④⑤⑥D. 只有④
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的电子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称:________、________、________。
(2)C在元素周期表中的位置是________
(3)B的原子结构示意图为____,C的氢化物与B的氢化物的稳定性强弱顺序为___>___(填化学式)。
(4)比较A、C的原子半径:A________(填“>”或“<”)C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是( )
A.H2Y的电离方程式为:![]()
B.在该酸式盐溶液中![]()
C.HY-的水解方程式为![]()
D.在该酸式盐溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
(1)5min末A的物质的量浓度为________。
(2)前5min内用B表示的化学反应速率v(B)为________。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。将变黑的银质器皿放入下图装置,一段时间后发现黑色会褪去。回答下列问题:
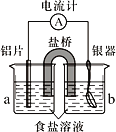
(1)铝为________极,KNO3盐桥中的________离子进入a烧杯中,银器的电极反应式为________。
(2)如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,负极的电极反应式是_________,总反应方程式_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com