
科目: 来源: 题型:
【题目】东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志。下列说法错误的是

A.青铜是我国使用最早的合金、含铜、锡、铅等元素
B.青铜的机械性能优良,硬度和熔点均高于纯铜
C.铜器皿表面的铜绿可用明矾溶液清洗
D.“曾青(![]() )得铁则化为铜”的过程发生了置换反应
)得铁则化为铜”的过程发生了置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】磷铁(含P、Fe、Cr等)是磷化工生产过程中产生的副产物,一种以磷铁为原料制备![]() 和
和![]() 的流程如图所示:
的流程如图所示:
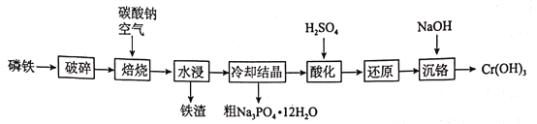
已知:水浸后溶液的主要成分为![]() 和
和![]() ;
;![]() 的
的![]() 回答下列问题:
回答下列问题:
(1)“破碎”的目的为________________________________________________________。
(2)“焙烧”时,应将原料加到________坩埚中(填“陶瓷”或“钢制”),原因是_____________(结合化学方程式解释),Cr单质发生的主要反应的化学方程式为________。
(3)进一步提纯粗磷酸钠晶体的方法为________________。
(4)“酸化”时发生反应的离子方程式为________________________________________________。
(5)“沉铬”时,加NaOH调节至pH为________时,铬离子刚好沉淀完全。(已知:![]() ,离子浓度为10-5mol/L时可认为该离子沉淀完全)
,离子浓度为10-5mol/L时可认为该离子沉淀完全)
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
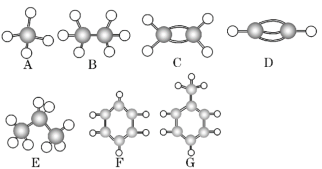
(1)常温下含氢量最高的气态烃是________(填字母)。
(2)能够使酸性高锰酸钾溶液褪色的烃有________种。
(3)写出F发生硝化反应的化学方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】O3在水中易分解。一定条件下,起始浓度均为0.0216mol/L的O3溶液,在不同的pH、温度下,发生分解反应,测得O3浓度减少一半所需的时间(t)如下表所示:

下列判断不正确的是
A. 实验表明,升高温度能加快O3的分解速率
B. pH增大能加速O3分解,表明OH-可以对O3的分解起催化作用
C. 在30℃、pH=4.0时,O3的分解速率为1.00×10-4mol/(L·min)
D. 据表中的规律可推知,O3在下列条件下的分解速率v(40℃、pH=3.0)>v(30℃、pH=7.0)
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X是一种烷烃,是液化石油气的主要成分,可通过工艺Ⅰ的两种途径转化为A和B、C和D。B是一种重要的有机化工原料,E分子中含环状结构,F中含有两个相同的官能团,D是常见有机物中含氢量最高的,H能使![]() 溶液产生气泡,Ⅰ是一种有浓郁香味的油状液体。
溶液产生气泡,Ⅰ是一种有浓郁香味的油状液体。
请回答:
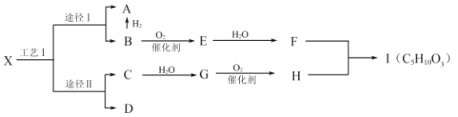
(1)G的结构简式为_________________________。
(2)G→H的反应类型是_________________________。
(3)写出F+H→1的化学方程式_________________________。
(4)下列说法正确的是_______。
A.工艺Ⅰ是石油的裂化
B.除去A中的少量B杂质,可在一定条件下往混合物中通入适量的氢气
C.X、A、D互为同系物,F和甘油也互为同系物
D.H与![]() 互为同分异构体
互为同分异构体
E.等物质的量的Ⅰ和B完全燃烧,消耗氧气的质量比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑(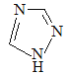 )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(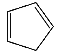 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
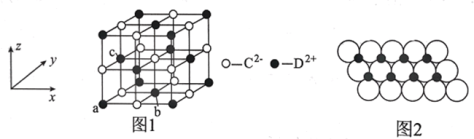
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的前36号元素,基态A原子的价电子排布式为nsnnpn,C原子基态时2p能级上有2个未成对的电子,D元素的原子结构中3d能级上成对电子数是未成对电子数的3倍,B与E同主族。
请回答下列问题:
(1)基态A原子的价电子轨道表示式为_______,其电子占据的最高能级的电子云形状为________。
(2)B、C、E三种元素的电负性由大到小的顺序为________(用元素符号表示)
(3)E的含氧酸有两种形式,化学式分别为H3EO3和H3EO4,则二者酸性强弱H3EO3_____H3EO4(填“>”“<”或“=”)
(4)D单质在AC气流中轻微加热,生成无色挥发性液态D(AC)4配合物,该配合物的晶体类型是_________。
(5)DC晶胞结构如图1所示,离子坐标参数a为(0,0,0),b为(![]() ,
,![]() ,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
,0),则c离子的坐标参数为________;一定温度下,DC晶体可自发地分散并形成“单层分子”,可以认为C2–作密置单层排列,D2+填充其中,如图2所示,C2–离子的半径为xm,阿伏加德罗常数的值为NA,则每平方米面积上分散的该晶体的质量为_____g(用含x、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究性学习小组为了探究一种无机盐A的组成(只含四种常见元素且阴阳离子个数比为1∶1),设计并完成了如下实验:
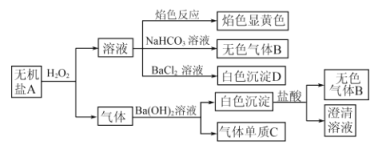
已知,标准状况下气体单质C的密度为1.25g·,白色沉淀D不溶于稀盐酸,气体B是无色无味的酸性气体。
(1)无机盐A中所含金属元素为_________________。
(2)写出气体C的结构式_________________。
(3)写出无机盐A与![]() 反应的离子方程式__________________________________。
反应的离子方程式__________________________________。
(4)小组成员在做![]() 离子检验时发现,待测液中加入A后,再加
离子检验时发现,待测液中加入A后,再加![]() ,一段时间后发现出现的血红色褪去。试分析褪色的可能原因。并用实验方法证明(写出一种原因即可)。
,一段时间后发现出现的血红色褪去。试分析褪色的可能原因。并用实验方法证明(写出一种原因即可)。
原因________________________,证明方法________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定质量的![]() 和
和![]() 固体的混合物溶于适量的水,将所得溶液等分成两份,向其中一份中缓慢逐滴加入某浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份中加入过量的
固体的混合物溶于适量的水,将所得溶液等分成两份,向其中一份中缓慢逐滴加入某浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份中加入过量的![]() 溶液,得到白色沉淀3.94g。试回答下列问题:
溶液,得到白色沉淀3.94g。试回答下列问题:
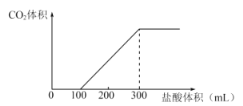
(1)盐酸的物质的量浓度为________________。
(2)固体混合物中![]() 的质量为________________。
的质量为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业纯碱中常常含有NaCl、![]() 等杂质。为测定某工业纯碱的纯度。设计了如图实验装置。依据实验设计,请回答:
等杂质。为测定某工业纯碱的纯度。设计了如图实验装置。依据实验设计,请回答:

(1)仪器D的名称是______________;装置D的作用是______________________。
(2)若不考虑操作、药品及其用量等方面的影响,该实验测得结果会___________(填“偏高”、“偏低”,“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com