
科目: 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是
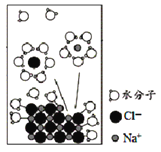
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以乙醇为主要原料合成一种具有果香味的物质 C 和化合物 D 的合成路线如图所示。
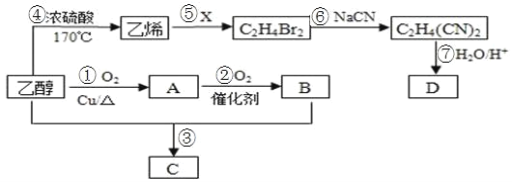
请回答下列问题:
(1)B的结构简式为_______。
(2)反应⑤的化学方程式为_______;B分子中的官能团名称为_______;反应⑥的类型为________。
(3)为了探究反应③的反应原理,通常采用“同位素示踪法”的方法,请结构简式为 CH3CH218OH,书写化反应③学方程式为_______。
(4)已知D的相对分子量为 118,其中碳、氢两元素的质量分数分别为 40.68%、5.08%,其余为氧元素,则 D 的分子式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(Ti)被誉为“21世纪的金属”,工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg ![]() Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为____________________;
(2)写出与CO互为等电子体的分子_________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体.
①TiCl4为______化合物(填“离子”或“共价”);
②TiCl4分子为正四面体形,则Ti为___________杂化.
③TiCl4在潮湿空气中水解的化学方程式是____________________;
④TiCl2、Cl2和C反应制得的TiCl4最好的提纯方法是__________(填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为_______,中心离子配位数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成40.0L N2(标准状况)B.有0.250mol KNO3被氧化
C.转移电子的物质的量为1.25molD.被氧化的N原子的物质的量为4.75mol
查看答案和解析>>
科目: 来源: 题型:
【题目】200℃时,11.6g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6g,再将反应后剩余固体冷却后加入含有Na+、HCO3-、SO32-、CO32-等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是
A.原混合气体的平均摩尔质量为23.2g/mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25mol
C.溶液中SO32-的物质的量浓度基本保持不变
D.溶液中HCO3-的物质的量浓度减小,CO32-的物质的量浓度增大,但是HCO3-和CO32-的物质的量浓度之和基本保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mL FeBr2溶液中通入标准状况下的氯气3.36L,测得所得溶液中c(Cl-)=c(Br-),则原FeBr2溶液物质的量浓度为
A.0.75mol/LB.1.5mol/LC.2mol/LD.3mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在某一容积为 2L 的恒容密闭容器中,A、B、C、D 四种气体物质发生可逆反应,其物质的量 n(mol)随时间 t(min)的变化曲线如图所示。回答下列问题:
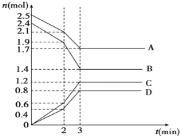
(1)该反应的化学方程式为____。
(2)前 2min 内用 A 的浓度变化表示的化学反应速率为____;
(3)在 2min 时,图象发生改变的原因可能是_____ (填字母)
A.增大 B 的物质的量 B.降低温度 C.加入催化剂 D.减小 A 的物质的量
(4)不同条件下的该反应的速率:①v(A)=1.0mol·L-1·s-1,②v(B)=1.0 m ol·L-1·s-1,③v(C)=1.2 mol·L-1·s-1,④v(D)=1.2mol·L-1·s-1。其中反应速率最快的是___ (填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】N元素的单质及其化合物之间的转化关系:NH3N2NO NO2HNO3。回答下列问题:
(1)N元素在元素周期表中的位置为_______;
(2)上述四种气体只能用排水法收集的是_______(填化学式,下同),只能用排空气法收集的是______;
(3)氮的氧化物是空气的主要污染物,下列环境问题与氮的氧化物排放有关的是_____;
A. 酸雨 B. 光化学烟雾 C. 白色污染 D. 臭氧层空洞
(4)NO2形成酸雨的化学方程式为______;
(5)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程______;
(6)若将12.8 g铜与 50 mL一定浓度的浓硝酸反应,两者恰好完全反应共产生气体5.6 L(标准状况),计算此浓硝酸的物质的量浓度_______(写出解题过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)
A.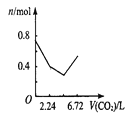 B.
B.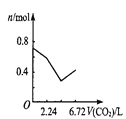 C.
C.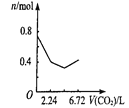 D.
D.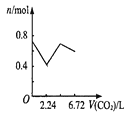
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com