
科目: 来源: 题型:
【题目】NA是阿伏加徳罗常数的值,下列说法正确的是
A.12g石墨烯(单层石墨)中含有六元环的个数为2NA
B.标准状况下,22.4LHF中含有的氟原子数目为NA
C.密闭容器中,lmolNH3和lmolHC1反应后气体分子总数为NA
D.在1L 0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】能够充分说明在恒温下的密闭容器中,反应2SO2+O2![]() 2SO3已达平衡状态的标志是
2SO3已达平衡状态的标志是
A. 容器中SO2.O2.SO3的物质的量之比为2:1:2
B. SO2 和SO3的物质的量浓度相等
C. 单位时间内生成2molSO3 时,即消耗1molO2
D. 反应容器内压强不随时间变化而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向2 L密闭容器中充入2 mol N2和10 mol H2发生反应N2+3H2![]() 2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
A. v(N2)=3 v(H2)B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=0.5mol·L-1·min-1D. 再充入2 mol N2化学反应速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O + Zn + H2O═2Ag + Zn(OH)2 ,示意图如下。下列判断正确的是( )
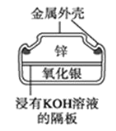
A.锌为负极,被还原
B.纽扣电池工作时,OHˉ移向Ag2O
C.每6.5 g 锌发生反应时,转移电子0.1 NA
D.纽扣电池工作时,电解质溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )

A.生成1molH2O时放出热量245kJ
B.H2O分解为H2与O2时放出热量
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:
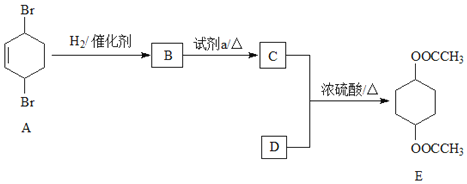
完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:
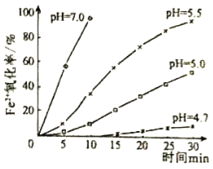
(1)写出Fe2+水解的离子方程式______;要抑制FeSO4水解,可以采取的措施是______。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O24Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200molL-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______molL-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的电子排布式为____________________。
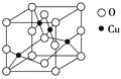
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
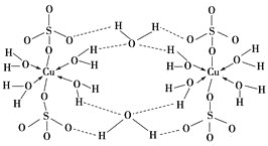
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配离子,其原因是______________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com