
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃,沸点在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中的S的化合价为_______________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为_______________。
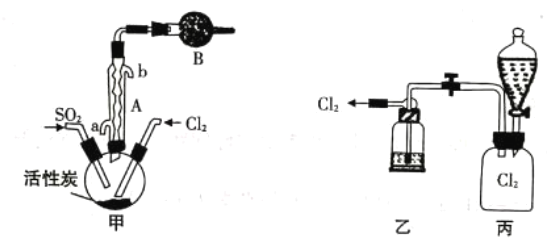
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(部分夹持装置未画出)。
①仪器A的名称为_______________,装置乙中装入的试剂是_______________,装罝B的作用是_______________。
②装置丙分液漏斗中盛装的最佳试剂是_______________(选填编号)。
A.蒸馏水 B.l0.0mol·L-1浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL0.50000mol·L-1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L-1标准HC1滴定至终点,重复实验三次取平均值,消耗HCl l0.00mL。达到滴定终点的现象为_______________,产品的纯度为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮元素是构成生物体的主要元素,在动植物生命活动中起着重要作用。根据要求回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在____________对自旋状态相反的电子。
(2)已知:(NH4)2CO3![]() 2NH3↑+H2O↑+CO2↑
2NH3↑+H2O↑+CO2↑
①与氧同周期,且第一电离能比氧大的元素有____________种。
②(NH4)2CO3分解所得的气态化合物分子的键角由小到大的顺序为____________(填化学式)。
(3)物质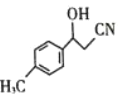 中C原子杂化方式是____________。
中C原子杂化方式是____________。
(4)配合物[Cu(CH3C![]() N)4]BF4中,铜原子的价电子布式为____________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
N)4]BF4中,铜原子的价电子布式为____________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
(5)碳元素与氮元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
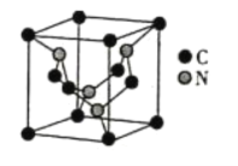
①晶胞中C原子的配位数为___________。该晶体硬度超过金刚石的原因是___________。
②已知该晶胞的边长为apm,阿伏加德罗常数用NA表示,则该晶体的密度为___________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业是以电解饱和食盐水为基础的化学工业。
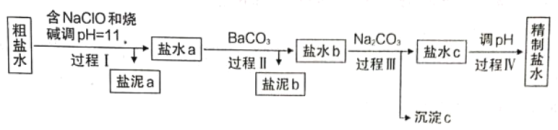
I.电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42-及泥沙,其精制流程如下:
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
Ca(OH)2 | Mg(OH)2 | |
pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
(1)盐泥a除泥沙外,还含有____________________________________。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________________。
(3)过程III中,沉淀c主要成分的化学式为________________________。
(4)过程IV调pH目的是____________。
II.如图是将电解池与燃料电池相组合电解精制饱和食盐水的新工艺,可以节(电)能30%以上。相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
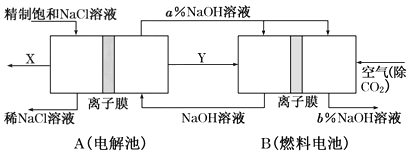
(1)图中X是____________(填化学式)。
(2)Y在装置B中发生的电极反应式为____________。
(3)写出A装罝中发生的总反应离子方程式____________,比较图示中氧氧化钠溶液质量分数a%与b%的大小:________________________。
(4)若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置B可向装置A提供的电量约为____________(一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)
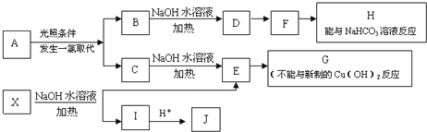
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为______;(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为______;
(3)E与H反应的化学方程式是________;反应类型是_______;
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是______;
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式_______;
①与FeCl3溶液作用显紫色
②与新制Cu(OH)2悬浊液作用产生红色沉淀
③苯环上的一卤代物有2种
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
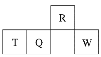
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q>W
C. 原子半径:T>Q>R
D. 单质T既可以与盐酸反应又能与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4 和H2O(g)的热化学方程式: __________________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2L的密闭容器中,充入1 molCO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
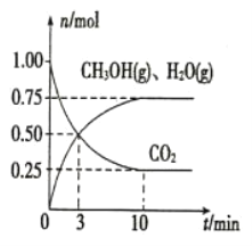
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________。
②下列措施一定不能使CO2的转化率增大的是_____________(选填编号)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中再充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)中CO的平衡转化率随
H2(g)+CO2(g)中CO的平衡转化率随![]() 及温度变化关系如图所示:
及温度变化关系如图所示:
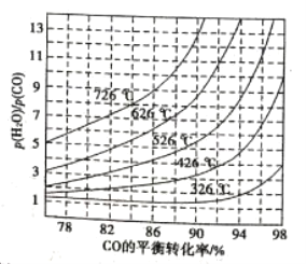
①上述反应的逆反应方向是_____________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp的表达式为______________,提高![]() ,则Kp_____________(填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、
,则Kp_____________(填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、![]() =3~5,采用此条件的原因可能是___________。
=3~5,采用此条件的原因可能是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为部分短周期非金属元素的性质或原子结构,已知A﹣D的原子序数依次增大。
元素编号 | 元素性质或原子结构 |
A | A原子所处的周期数、族序数、原子序数均相等 |
B | 核外电子有6种不同运动状态 |
C | 最简单氢化物的水溶液呈碱性 |
D | 基态原子的s轨道电子数等于p轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号):
(1)写出C原子的电子排布图________。
(2)A,B,C,D的第一电离能由大到小的顺序为________。
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因________。按照共价键理论,分子中每个原子的最外电子层电子数均已饱和,已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是______,向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为_______,分子中C的原子的杂化类型是______;若无配位键则ABCD的结构式为______分子中D原子的杂化类型为________。
(5)BD2的电子式是________将D原子换成等电子的 ![]() 所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
(6)在ABCD的三种可能结构中B原子的杂化类型________(填“相同”或“不相同”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
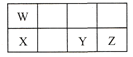
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料 (NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理 为Na1-mCoO2+NamCn![]() NaCoO2+Cn。下列说法不正确的是
NaCoO2+Cn。下列说法不正确的是
A.放电时,Na+向正极移动
B.放电时,负极的电极反应式为NamCn—me-=mNa++Cn
C.充电时,阴极质量减小
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com