
【题目】氯碱工业是以电解饱和食盐水为基础的化学工业。
I.电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42-及泥沙,其精制流程如下:
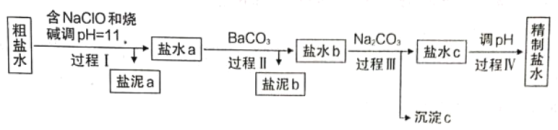
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
Ca(OH)2 | Mg(OH)2 | |
pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
(1)盐泥a除泥沙外,还含有____________________________________。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________________。
(3)过程III中,沉淀c主要成分的化学式为________________________。
(4)过程IV调pH目的是____________。
II.如图是将电解池与燃料电池相组合电解精制饱和食盐水的新工艺,可以节(电)能30%以上。相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
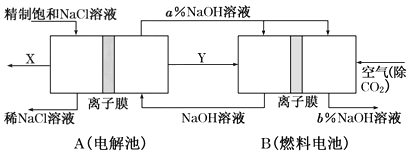
(1)图中X是____________(填化学式)。
(2)Y在装置B中发生的电极反应式为____________。
(3)写出A装罝中发生的总反应离子方程式____________,比较图示中氧氧化钠溶液质量分数a%与b%的大小:________________________。
(4)若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置B可向装置A提供的电量约为____________(一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
【答案】含有Mg(OH)2 3C1O-+2 NH4++2OH-=3Cl-+ N2↑+5H2O CaCO3 除去多余的CO32-和OH- Cl2 H2-2e-+2OH-=2H2O 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- b%>a% 1.93×105C
Cl2↑+H2↑+2OH- b%>a% 1.93×105C
【解析】
Ⅰ除去有影响的Ca2+、Mg2+、NH4+、SO42-及泥沙,过程Ⅰ加入NaClO和烧碱后调pH=11,可以除去泥沙和Mg2+,NaClO的作用是将NH4+转化为N2,可以除去NH4+,盐水a中含有Ca2+、SO42-。根据已知②可知,加入BaCO3后,由于BaSO3的Ksp小于BaSO4的Ksp,所以BaCO3会转化为BaSO4,从而除去SO42-,但Ca2+没有除去。盐泥b中有BaSO4,盐水b中有Ca2+和少量的CO32-。过程Ⅲ可以除去Ca2+,沉淀c是CaCO3,过程Ⅳ可以通过调pH(即加入盐酸)除去CO32-和OH-,得到精制盐水。
ⅡA装置是电解池,B装置是原电池。电解氯化钠溶液的生成物是氯气、氢气和氢氧化钠,所以X是氯气,Y是氢气,在装置B中做负极,失电子;氧气在正极通入得电子。
Ⅰ(1)根据表格可知,pH=11时,Mg(OH)2开始沉淀,Ca(OH)2没有沉淀,所以盐泥中还有Mg(OH)2。
(2)NaClO与NH4+反应生成N2,氮元素的化合价升高,次氯酸根中氯的化合价降低到-1,配平得到离子方程式为3C1O-+2 NH4++2OH-=3Cl-+ N2↑+5H2O。
(3)根据分析可知,沉淀c是CaCO3。
(4)根据分析可知,过程Ⅳ的作用是除去多余的CO32-和OH-。
Ⅱ(1)根据分析可知, X是Cl2。
(2)氢气在负极发生的电极反应式为H2-2e-+2OH-=2H2O。
(3)A装罝中阳极是Cl-失去电子生成Cl2,阴极是水电离的H+得到电子生成H2,发生的总反应离子方程式是2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。从电解池产生的a%的NaOH进入原电池中,在原电池的正极上氧气得到电子:O2+4e-+2H2O=4OH-, OH-浓度增大,Na+又通过离子膜移动到正极室,所以正极室中NaOH溶液的浓度增大,因此b%>a%。故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-。从电解池产生的a%的NaOH进入原电池中,在原电池的正极上氧气得到电子:O2+4e-+2H2O=4OH-, OH-浓度增大,Na+又通过离子膜移动到正极室,所以正极室中NaOH溶液的浓度增大,因此b%>a%。故答案为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,b%>a%。
Cl2↑+H2↑+2OH-,b%>a%。
(4)消耗标准状况下氧气的体积为11.2L(即0.5mol)时,转移电子2mol,则装置B可向装置A提供的电量约为2mol×6.02×![]() ×1.60×10-19C= 1.93×105C。
×1.60×10-19C= 1.93×105C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①晶体中分子间作用力越大,分子越稳定 ②原子晶体中共价键越强,熔点越高 ③干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在Na2O和Na2O2晶体中,阴、阳离子数之比相等 ⑤正四面体构型的分子,键角都是109°28′,其晶体类型可能是原子晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8 g碳元素的金刚石晶体中的共价键的物质的量为0.8 mol
A. ①②③④⑤ B. ②④⑦ C. ⑤⑥⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按右图装置进行制取。
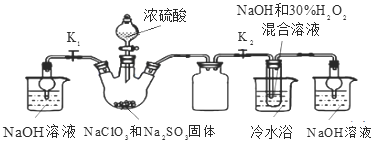
A B C D E
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____(填仪器名称);装置C的作用是_____________________。
(2)B中产生ClO2的化学方程式______________________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________________________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_________,检验该离子的方法是___________________________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________;
实验Ⅱ:样品杂质分析与纯度测定
(6)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________mol(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
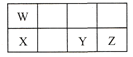
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H( )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:(1)E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
(2)![]() (R为烃基)
(R为烃基)
(3)![]()
请回答下列问题:
(1)A的结构简式为_____;D的官能团的名称为_____。
(2)①的反应类型是_____;④的反应条件是_____。
(3)写出B→C的化学方程式_____。
(4)写出F+G→H的化学方程式_____。
(5)E有多种同分异构体,同时满足下列条件的E的同分异构体有_____种。
ⅰ.能发生银镜反应 ⅱ.能发生水解反应 ⅲ.分子中含的环只有苯环
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间CH3CONHCH(CH3)2的合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是( )

A.分子中含有三种含氧官能团
B.1 mol该化合物最多能与6molNaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与FeC13发生显色反应,也能和Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.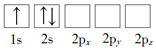 B.
B.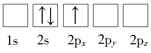
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
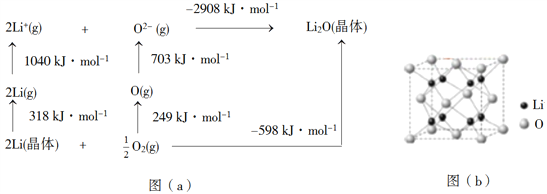
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com