
科目: 来源: 题型:
【题目】下表列出9种元素在周期表中的位置,请按要求回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)⑦的简单离子的结构示意图是______。表中标注的元素的最高价氧化物对应的水化物中碱性最强的碱是_____(填写化学式)。③、④、⑨三种元素按原子半径由大到小的顺序排列为 ______ (用元素符号表示)。
(2)元素②的气态氢化物的电子式是_______。由3个元素②的原子组成带一个单位负电荷的阴离子中含有_______个电子。写出该元素氢化物与其最高价氧化对应水化物反应的离子方程
式_____________。
(3)⑦、⑧两元素简单离子还原性强弱为______(填离子符号)。
(4)某研究性学习小组设计了一组实验验证元周期律。
Ⅰ:甲同学在A、B两只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的③、⑨元素单质,观察现象。甲同学设计实验的目的是_____。写出元素⑨的单质与水反应的化学方程式为________。
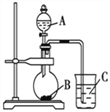
Ⅱ:乙同学设计如图装置以验证①、⑥、⑦元素的非金属性强弱。为了达到实验目的,仪器A、B、C分别选择的药品为A______、B______、C______;烧杯中发生反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
(1)氢气在O2中燃烧的反应是______热反应(填“放”或“吸”),这是由于反应物的总能量______生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,氢气的燃烧是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量。已知破坏1mol H-H键、1mol O=O键、1mol H-O键时分别需要吸收a kJ、b kJ、c kJ的能量。则2mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为
____________________kJ。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池.该电池的正极是___(填a或b),负极反应式为______________。
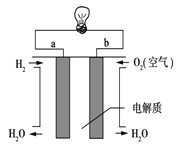
(4)若将右图中的氢氧燃料电池用固体金属氧化物陶瓷作电解质(能够传导O2-),已知正极上发生的电极反应式为:O2+4e-===2O2-则负极上发生的电极反应式为________;电子从________极(填a或b)流出。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物是一种医药中间体。其结构简式如图所示,下列有关该物质的说法正确的是
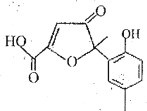
A.该化合物分子中只含一个手性碳原子
B.该化合物与NaHCO3溶液作用有CO2气体放出
C.1mol该化合物与足量溴水反应,消耗3molBr2
D.在一定条件下,该化合物与HCHO能发生缩聚反应
查看答案和解析>>
科目: 来源: 题型:
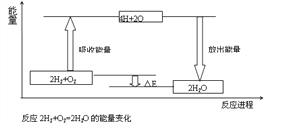
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)
查看答案和解析>>
科目: 来源: 题型:
【题目】依据Cd(Hg)+Hg2SO4=3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图。下列有关该电池的说法正确的是
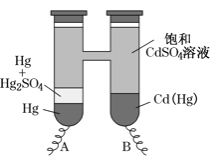
A.电池工作时Cd2+向电极B移动
B.反应中每生成amolHg转移2amol电子
C.电极B上发生的反应:Cd(Hg)-4e-=Hg2++ Cd2+
D.电极A上发生的反应:Hg2SO4+2e-=2Hg+ SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作和现象、结论都正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 常温下,将大小、形状形态的锌和铝分别加入到等体积 | 锌比铝活泼 |
B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有 |
C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
D | 向某溶液中加入氢氧化钠溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:
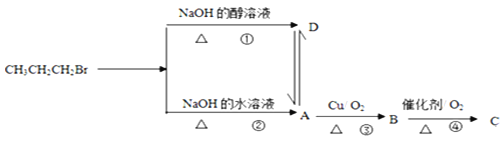
(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备1,2—二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
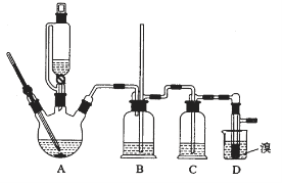
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
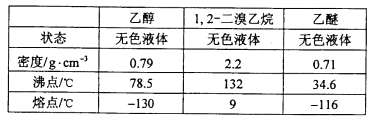
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________;(填正确选项前的字母)
a. 引发反应 b. 加快反应速度
c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的方法是D装置中____________________________;
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,溶液分层,产物应在______层(填“上”“下”);分离该有机物的方法叫_______________。
(5)若产物中有少量乙醚生成,最好用__________除去;(填正确选项前的字母)
a蒸发 b 蒸馏 c 重结晶
(6)反应过程中应用冷水冷却装置D,其主要目的是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com