
科目: 来源: 题型:
【题目】目前中国已经通过自主创新成功研发出第一台锌溴液流储能系统,实现了锌溴电池的隔膜、极板、电解液等关键材料自主生产。锌溴电池的原理装置图如图所示,下列说法错误的是( )

A.充电时电极石墨棒A连接电源的正极
B.放电过程中阴离子通过隔膜从正极区移向负极区
C.放电时负极反应为2Br-—2e-=Br2
D.放电时右侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是
A.某温度下,1 L pH = 6 的纯水中含 OH一为10-8mol
B.25℃ 时,向0. 1 mo lL-1 CH3COONa 溶液中加入少量水,溶液中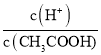 减小
减小
C.25℃时,将 V1 L pH = 11的 NaOH溶液与V2 L pH = 3 的H A 溶液混合,溶液显中性,则V1 ≤V2
D.25℃时,将 a molL-1 氨水与0.01 molL- 1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示 NH3H2O)的电离常数 Kb = ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或现象不能用平衡移动原理解释的是
A. 卤化银沉淀的转化

B. 配制FeCl3溶液

C. 淀粉在不同条件下水解

D. 探究石灰石与稀盐酸在密闭环境下的反应

查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)与钛(Ti)是均可与强酸发生反应的金属。利用电解原理电解CoCl2溶液制取钴,工作原理如图所示,其中Ti-Ru为惰性电极。下列说法正确的是
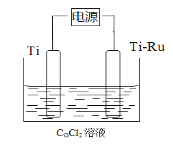
A. 电解时控制CoCl2溶液的pH在0~1范围内
B. 电解过程中Cl在Ti电极放电生成氯气
C. Ti-Ru的作用是作为损耗阳极材料和传递电流
D. 用CoSO4代替CoCl2会使钴的产率降低
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.高锰酸钾与浓盐酸反应制氯气:MnO4-+ 8H+ + 4Cl-=Mn2++2Cl2↑+4H2O
B.饱和碳酸钠溶液中通入过量二氧化碳:CO32-+ H2O+ CO2=2 HCO3-
C.铜片与浓硫酸共热:Cu + 4H++ SO42-![]() Cu2+ + SO2↑+ 2H2O
Cu2+ + SO2↑+ 2H2O
D.硫酸铜溶液中加入过量氨水:Cu2+ +4NH3H2O=Cu(NH3)42++4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】[Cu(NH3)4]SO4是一种深蓝色的配位化合物。
(1)Cu2+可被还原成Cu+,Cu+基态核外的外围电子排布式为_________________________。
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,则该分子中N原子的杂化轨道类型为______________________。
(3)与CS2分子互为等电子体的SCN-离子的电子式为_________________。
(4)Cu可形成多种配合物,且各种配合物有广乏的用途。某Cu的配合物结构如图1所示,则该配合物中心原子Cu的配体数为____;其分子内含有的作用力有________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位健
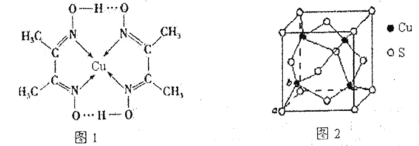
(5)Cu元素与S元素形成的一种化合物品跑如图2所示,其中S的配位数为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式:
SO2(g)+NH3H2O(aq)=NH4HSO3(aq) △H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=____kJmol﹣1。
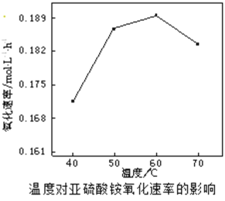
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是________。
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K=________.[已知Ksp(CaCO3)=2.9×10﹣9,Ksp(CaSO4)=9.1×10﹣6]
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是
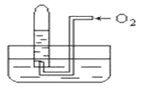
A.NO2一种气体B.O2与NO2的混和气体
C.NO与NO2的混和气体D.N2与NO2的混和气体
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次递增的Q、W、X、Y、Z五种元素中,Q、W、X是分别位于前三个周期且原子最外层电子数之和为10的主族元素,W与Y同主族、X和Y同周期;X是地壳中含量最高的金属元素、Z存在胆矾之中。下列关于它们的叙述合理的是
A. 最高价氧化物对应水化物的碱性比X比Z弱
B. W与X简单离子半径后者更大
C. W、Y两种元素最高化合价相同
D. X、Z两种金属在两千多年前就被我们祖先广泛使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com