
科目: 来源: 题型:
【题目】硫代硫酸钠俗称大苏打、海波,主要用作照相业定影剂,还广泛应用于鞣革、媒染、化工、医药等行业。常温下,溶液中析出晶体为Na2S2O35H2O.Na2S2O35H2O于40-45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图甲所示。
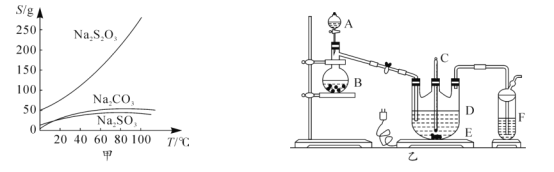
Ⅰ.制备Na2S2O35H2O
将硫化钠和碳酸钠按反应要求比例放入图乙装置D中,然后注入150mL蒸馏水使其溶解,再在分液漏斗A中注入一定浓度的H2SO4,在蒸馏烧瓶B中加入亚硫酸钠固体,并按图乙安装好装置。
(1)仪器D的名称为______
(2)打开分液漏斗活塞,注入H2SO4,使反应产生的气体较缓慢均匀地通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,总反应方程式为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。
3Na2S2O3+CO2。
①烧瓶B中发生反应的化学方程式为______。
②将B中产生的气体缓慢均匀地通入D中的正确操作是______。
③制备过程中仪器D中的溶液要控制在弱碱性条件下,其理由是______(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量

(3)操作I为趁热过滤,其目的是______;操作Ⅱ是过滤、洗涤、干燥,其中洗涤操作时用______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液中有少量晶体析出为止,蒸发时控制温度不宜过高的原因是______。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,称取1.25g的粗样品溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.0100mol/L标准I2溶液滴定,当溶液中S2O32-全部被氧化时,消耗碘溶液的体积为25.00mL.试回答:(提示:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象:______
②产品中Na2S2O35H2O的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
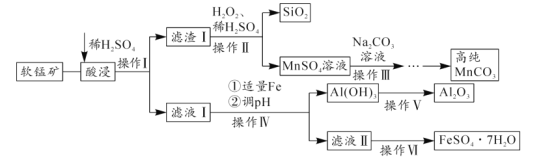
【题目】软锰矿的主要成分为MnO2,还含有SiO2、Al2O3、Fe2O3、FeO等杂质。软锰矿经过综合利用,可制备碳酸锰、氧化铝及绿矾( FeSO47H2O),其制备过程如图:
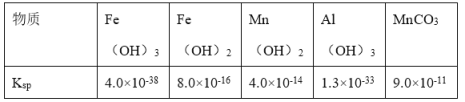
部分物质的Ksp如表:
回答下列问题:
(1)操作I中需要的仪器有______(填字母序号)。
a.蒸发皿 b.酒精灯c.漏斗 d.玻璃棒 e.烧杯
(2)操作Ⅱ中反应的离子方程式为______。
(3)操作Ⅲ中也可用NaHCO3与MnSO4溶液反应制备碳酸锰,其反应的离子方程式为______。
(4)操作Ⅳ中加入适量Fe的目的是______;当调节pH=______时(结果保留整数),可确定Al(OH)3完全沉淀。(已知:完全沉淀后,溶液中离子浓度不高于10-5molL-1)
(5)操作Ⅵ中一般要加入稀硫酸,目的是______,然后______、冷却结晶、______、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】丙三酸是一种有机酸,用H3A表示。25℃时,向1molL-1的H3A溶波中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列相关说法错误的是( )
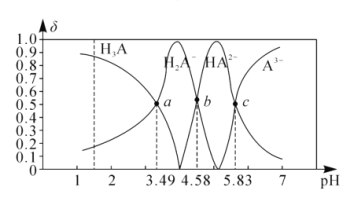
A.a点溶液中:c(H2A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,H3A的第二步电离平衡常数的数量级为10-5
C.b点溶液中:c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
D.当该溶液中c(HA2-)=c(A3-)时,溶液中水电离出的c(H+)>10-7molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
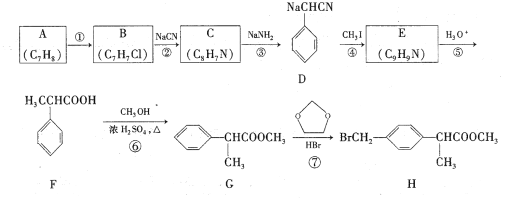
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )

A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】山梨酸和苯甲酸都是制备防腐剂的原料,他们的键线式如图所示。下列说法正确的是( )
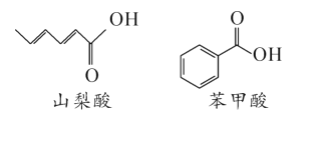
A.它们都能发生加成和氧化反应
B.苯甲酸分子中所有的原子共平面
C.山梨酸和苯甲酸互为同系物
D.山梨酸与足量H2反应后所得产物的一氯代物有6种(不考虑立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓![]() 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
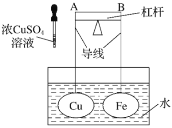
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
D.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是
A. Ba(HCO3)2溶液与Ba(OH)2溶液 B. NaAlO2溶液与稀硫酸溶液
C. Ca(HCO3)2溶液与NaOH溶液 D. 氨水与硝酸银溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com