
科目: 来源: 题型:
【题目】对于反应2HI(g) ![]() H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
A. 混合气体的颜色不再变化
B. 温度和体积一定时,容器内压强不再变化
C. lmolH-H键生成的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的矿产、能源和水产资源,如图所示利用海水的部分流程。
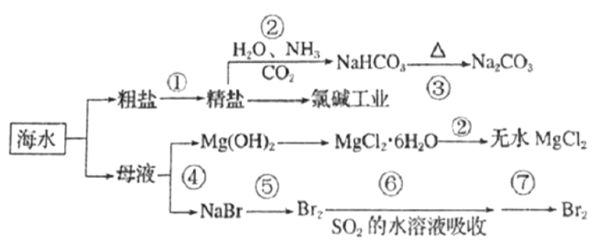
下列有关说法正确的是( )
A. 步骤②制取NaHCO3的原理是利用其溶解度比较小
B. 步骤②属于化合反应,步骤③属于分解反应
C. 在⑤⑥⑦步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
B. 2.3g钠在空气中燃烧生成多种氧化物是转移电子数为0.1NA
C. 1.8g D2O中含有的质子数为1.0NA
D. 235g核素![]() 发生裂变反应
发生裂变反应![]() +
+ ![]()
![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】键线式是表达有机化合物结构的一种方式,如H2N—CH2—CH2—OH 用键线式可以表达为 ![]() 。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
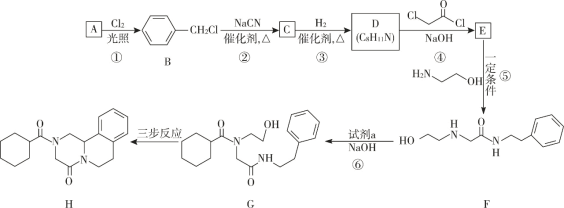
已知:I R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii 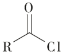 +R′—NH—R"+NaOH
+R′—NH—R"+NaOH![]()
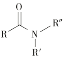 +NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
+NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
(1)A 属于芳香烃,其名称是____________ 。
(2)②的反应类型是_____________ 。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为_____________ 。
(4)③中 1 mol C 理论上需要消耗 ___________mol H2 生成 D。
(5)④的化学方程式是_____________ 。
(6) 试剂 a 的结构简式是 ____________________。
(7) G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式________________、__________________。
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中的说法错误的是( )
A. 化学反应中有物质变化也有能量变化。
B. 化学键断裂吸收能量,化学键生成放出能量。
C. 需要加热的化学反应不一定是吸热反应。
D. 如图所示的反应为放热反应。
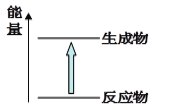
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。完成下列问题:
(1)写出元素符号:W为________,X为_________,Y为__________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为___________。
(3)由Y、X、W组成的物质是由_________键和__________键组成的___________化合物。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2-硝基-1,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:
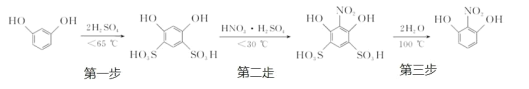
部分物质的相关性质如下:
名称 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 白色针状晶体 | 110.7 | 易溶 |
2-硝基-1,3-苯二酚 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化。称取一定质量的间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内反应 15 min(如图 1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅15 min。第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶 B 中,然后用图 2 所示装置进行水蒸气蒸馏,收集馏出物,得到 2-硝基-1,3-苯二酚粗品。
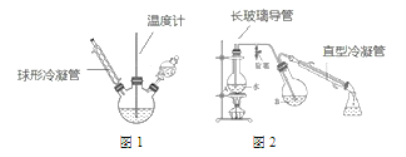
请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)________。
a.30 ℃~60 ℃ b.60 ℃~65 ℃ c.65 ℃~70 ℃ d.70 ℃~100 ℃
(2)酚羟基邻对位的氢原子比较活泼,均易被取代,请分析第一步磺化引入磺酸基基团(-SO3H)的作用是_______________________。
(3)硝化步骤中制取“混酸”的具体操作是______________________。
(4)下列说法正确的是_______________。
a 直型冷凝管内壁中可能会有红色晶体析出
b 图 2 中的冷凝管能用图 1 中的冷凝管代替
c 烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小引起倒吸。
(5)蒸馏步骤中,水蒸气蒸馏的作用是__________________。可通过________(填操作)进一步提纯 2-硝基-1,3-苯二酚。
查看答案和解析>>
科目: 来源: 题型:
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
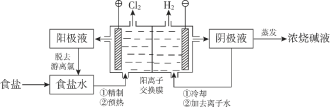
(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。
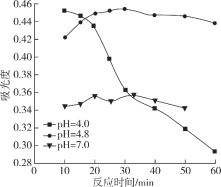
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目: 来源: 题型:
【题目】将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
(1)5 min后A的浓度__________________。
(2)B的平均反应速率为___________________。
(3)x的值为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com