
科目: 来源: 题型:
【题目】某同学采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、 SiO2、A12O3,不考虑其他杂质)制取绿碱FeSO47H2O),设计了如下流程(部分物质已略去)。
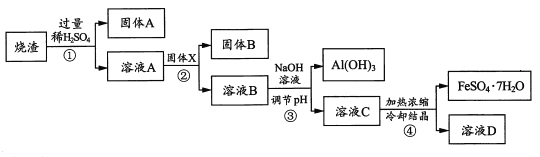
请回答:
(1)①一④所涉及的实验操作方法中,包含过滤的有____(写序号)。
(2)写出①中反应的离子方程式:____。
(3)下列说法正确的是___(填字母)。
a.固体x为铁粉
b.溶液B中含有的阳离子主要是Fe2+、Fe3+、Al3+
c.从溶液C到绿矾的过程中,须控制条件防止其氧化
(4)为测定烧渣中Fe2O3的含量,甲同学通过实验测得如下数据:烧渣的质量为ag,固体x的质量为bg,固体B的质量为cg。乙同学认为仅利用以上数据不能计算出烧渣中Fe2O3的含量,其理由是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:

(1)写出③、⑤两种元素形成的化合物有两种,电子式分别是:__,___。
(2)写出①元素形成最简单有机物是__,它和氯气反应的一个方程式__。
(3)这些元素的最高价氧化物的对应水化物中__酸性最强;__碱性最强;能形成两性氢氧化物的元素是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)可以用来鉴别甲烷和乙烯的试剂是 。
A.水
B.稀硫酸
C.溴水
D.酸性高锰酸钾溶液
(2)在一定条件下,乙烯能与水反应生成有机物A,则A的结构简式是 。
(3)某同学在学习A的知识后,设计了如下实验。操作步骤为:
①在试管里加入2 mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
第④步操作中,铜丝表面的变化是 ;写出第③步操作中发生反应的化学方程式: 。
(4)A在一定条件下可以被氧化成乙酸,用化学方程式说明乙酸和碳酸的酸性强弱: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在“测定1mol气体体积”的实验中,我们通常选择的测量气体是氢气,反应是镁和稀硫酸反应。图中的A、B、C三部分能组成气体摩尔体积测定装置:

(1)C装置的名称是___________________。
(2)A、B、C装置接口的连续顺序是_________________。
(3)该装置正确连接后怎样做气密性检查?_________________。
(4)本实验中有两次针筒抽气,需要记录的是第____次抽出气体的体积。
(5)下表是某同学记录的实验数据:温度:25℃,气压:101.3kPa
实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
1 | 0.115 | 10.0 | 124.8 | 7.0 |
2 | 0.110 | 10.0 | 120.7 | 6.2 |
计算两次实验1mol氢气的体积的平均值=____L(保留一位小数,镁的相对原子质量为24.3)。
(6)已知实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=____%(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe3O4中含有Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程如图所示。下列说法正确的是( )
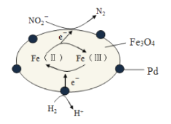
A.Pd作正极
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被Fe(Ⅱ)氧化为N2
D.用该法处理后水体的pH降低
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A.达到化学平衡时4υ正(O2)=5υ逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达平衡状态
C.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
D.平衡时混合物中可能各物质的浓度相等,且保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铜晶体(CuSO4·![]() H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量
H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量![]() 的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
坩埚质量 | 坩埚和晶体的质量 | 完全失去结晶水后坩埚和剩余固体的质量 |
11.685g | 13.691g | 12.948g |
(1)要完成此实验,至少要称量______次。
(2)![]() ______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
(3)造成本次误差可能的原因是______。
A. 加热时有晶体溅出
B. 实验前坩埚内有受热不挥发、不分解也不与硫酸铜反应的杂质
C. 粉末未完全变白就停止加热
D. 加热后放在空气中冷却
(4)请写出造成本次误差还有可能存在的其他原因(写出其中一点)_____________________。
(5)如果硫酸铜晶体样品不纯,测定结果________。
A.没有偏差 B. 一定偏小 C. 一定偏大 D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象及所得结论均正确的是( )
实验 | 实验现象 | 结论 |
A. | 左侧试管比右侧试管中产生气泡的速率快 | Fe3+对H2O2分解的催化效果更好 |
B. | 左侧棉花变为橙色,右侧棉花变为蓝色 | 氧化性:Cl2>Br2> I2 |
C. | U形管左端液面下降,右端液面上升 | NH4NO3溶解吸热 |
D. | 烧杯中产生白色沉淀 | 甲烷与氯气光照条件下发生取代反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C.![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() →
→![]() +HBr;
+HBr;![]() +H2→
+H2→![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com