
科目: 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。

回答下列问题:
(1)甲的分子式为 __________。
(2)丙中含有官能团的名称是__________。
(3)反应①的反应类型是________;反应②的反应类型是_______。
(4)反应④的化学方程式_______。
(5)符合下列条件的乙的同分异构体共有______种。
①能发生银镜反应
②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。
写出其中在核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式:________。(任意一种)
(6)设计以![]() (丙酮)、乙醇、乙酸为原料制备
(丙酮)、乙醇、乙酸为原料制备![]() (2,4—戊二醇)的合成路线(无机试剂任选)_______。
(2,4—戊二醇)的合成路线(无机试剂任选)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的有
①除去乙烷中混有的乙烯可以将气体通过足量KMnO4溶液;
②超导陶瓷在某一临界温度下电阻为零,可用于电力、交通、医疗等领域;
③煤燃烧时加入适量石灰石,可减少废气中SO2的量;
④可以用加热氯化铵固体,再用碱石灰除去氯化氢的方法制氨气;
⑤高分子材料中的有机物分子均呈链状结构;
⑥除去粗盐溶液中的Ca2+、Mg2+和SO![]() ,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞德西韦(Remdesivir)是一种核苷类似物,具有抗病毒活性,对新型冠状病毒(2019-nCoV)病例展现出较好的疗效。其结构如图a所示,回到下列问题:
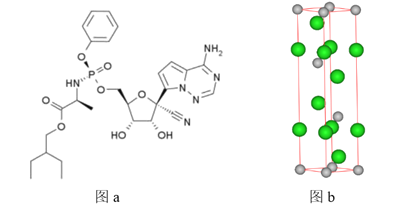
(1)该结构中P原子价电子的轨道表示式为_________。
(2)该结构中处于第二周期原子第一电离能从大到小的顺序为_______(用化学用语回答)。
(3)该结构氨基中N的杂化方式为_________,该分子间的作用力有________。
(4)苯酚(C6H5OH)为合成反应物之一,苯酚的晶体类型是_________,与甲苯(![]() )的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
)的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
(5)某镨(59Pr)的化合物是合成该分子的催化剂之一,则镨元素位于元素周期表中的__________区。MgCl2也是合成瑞德西韦的催化剂,晶胞如图b所示,则Mg2+处于氯离子围成的___________空隙中。晶胞参数为acm、acm、bcm,则该晶体的密度为_____________g/cm3。(填表达式,已知底面夹角分别为120°、60°,侧面与底面垂直)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 丙烯的结构简式为CH2CHCH3
B. 新戊烷的二氯代物有2种
C. 分子式为CH4O和C2H6O的物质一定互为同系物
D. 键线式为 的有机物的分子式为C8H10
的有机物的分子式为C8H10
查看答案和解析>>
科目: 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图,据图推断错误的是

A. 结合水与自由水含量的比值,与小麦的抗寒性呈正相关
B. 总含水量下降是因为细胞呼吸增强,需要消耗更多的水
C. 随着气温和土壤温度的下降,小麦的含水量下降
D. 11月时,小麦细胞中含量最多的化合物仍是水
查看答案和解析>>
科目: 来源: 题型:
【题目】随着环境污染的加重和人们环保意识的加强,生物降解材料逐渐受到了人们的关注。以下是PBA(一种生物降解聚酯高分子材料)的合成路线:

已知:①烃A的相对分子质量为84,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色。
②化合物C中只含一个官能团。
③R1CH=CHR2 ![]() R1COOH+R2COOH。
R1COOH+R2COOH。
④RC≡CH+ →
→ 。
。
请回答下列问题:
(1)由A生成B的反应类型为______________。
(2)由B生成C的化学方程式为____________________________。
(3)E的结构简式为____________________________________。
(4)F的名称为__________(用系统命名法);由D和F生成PBA的化学方程式为____________________________;
(5)E的同分异构体中能同时满足下列条件的共有_________种。(不含立体异构)
①链状化合物②能发生银镜反应③氧原子不与碳碳双键直接相连
其中,核磁共振氢谱显示为2组峰,且峰面积比为2∶1的是_________(写结构简式)。
(6)若由1,3丁二烯为原料(其他无机试剂任选)通过三步制备化合物F,其合成路线为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
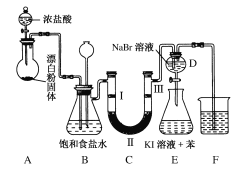
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是________,请写出该反应相应的化学方程式: ___________________________________。
(2)实验室常用以下几种方法制取氯气。
a.二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式______________。
b.氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为____。
(3)装置B中饱和食盐水的作用是________;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________。
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是________(填字母编号)。
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________,该现象________(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_________________。
(6)装置F的作用是_________,其烧杯中的溶液不能选用下列中的________(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
(7)氯气可制漂白粉,测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol/LKI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3ClO-+I-=3Cl-+IO3-;IO3-+5I-+3H2O=6OH-+3I2,实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验:
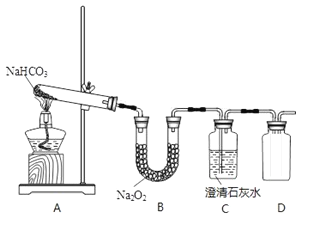
(1)写出装置A中反应的化学方程式________。
(2)写出装置B中反应的化学方程式________。
(3)拟用装置D收集气体产物,请将装置补充完整________。
(4)产物检验:检验气体产物的方法________。
(5)检验固体产物的方法:从B装置中取少量固体,溶于水配成溶液,________。
(6)有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0

①曲线c对应的温度是_____。
②关于工业合成氨的反应,下列叙述正确的是_____(填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________。
②该反应的化学平衡常数表达式是_____。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____。
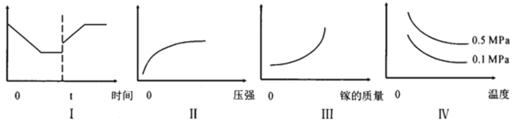
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
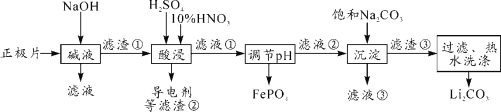
(1)“碱溶”时Al箔溶解过程中,氧化剂是______________。
(2)“酸浸”时生成NO的离子方程式是_________。(其他杂质不与HNO3反应)
(3)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率为90%,则加入饱Na2CO3 溶液中c(Na2CO3)=______ mol·L-1。[Ksp(Li2CO3)=1.6×10-3]
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的_____(填“正极”或“负极”);放电时,正极反应式为_______。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的_____(填“正极”或“负极”);放电时,正极反应式为_______。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.20g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.020mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是_________。
②磷酸亚铁锂电池中铁的含量为________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com