
科目: 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为__;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是__。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为__;甘氨酸易溶于水,试从结构角度解释__。
(3)一水合甘氨酸锌中Zn2+的配位数为__。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1molIMI中含有__σ键。
,则1molIMI中含有__σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态,原因是__。

(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
①Zn2+填入S2-组成的__空隙中(填“四面体”或“八面体”);
②由图不能判断出S2-、Zn2+相切,若要使S2-、Zn2+相切,则Zn2+半径为__pm,已知晶体密度为dg/cm3,S2-半径为apm。(写计算表达式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂。虽然是一种“农药”,但它不仅在田间地头,在我们百姓家庭中也随处可见,如蚊香等。下图所示是一种拟除虫菊酯——溴氰酯的结构简式:
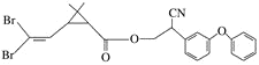

下列对该化合物的叙述中,正确的是( )
A.含有羧基B.可使酸性KMnO4溶液褪色
C.不能燃烧D.该化合物含有苯环,属于烃
查看答案和解析>>
科目: 来源: 题型:
【题目】银锌纽扣电池,其电池的电池反应式为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
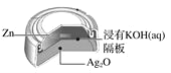
A.锌作负极
B.正极发生还原反应
C.电池工作时,电流从Ag2O经导线流向Zn
D.电池工作时,溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴(CoCO3)的工艺流程如图:
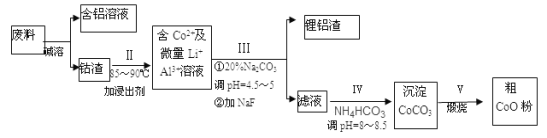
(1)写出一条加快碱溶速率的措施__。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为__(产物中只有一种酸根)。该过程不能用盐酸代替硫酸进行酸化,原因是_。
(3)过程Ⅲ中碳酸钠溶液的作用是沉淀Al3+和Li+,写出沉淀Al3+的离子方程式__。
(4)过程Ⅳ沉钴的离子方程式是__。
(5)CoCO3可用于制备锂离子电池的正极材料LiCoO2,其生产工艺是将n(Li):n(Co)=l:l的Li2CO3和CoCO3的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=-lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法不正确的是
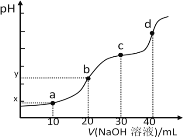
A.溶液的导电性:点a弱于点b
B.离子浓度c(R2-):点c大于点d
C.H2R+R2-=2HR-平衡常数>105,反应趋于完全
D.点b时,y<7且![]() <1
<1
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑨ | |||||
3 | ① | ③ | ④ | ⑤ | ⑧ | |||
4 | ② |
(1)①~⑨中,最活泼的金属元素是________,最不活泼的元素是______。(写元素符号)。
(2)⑦和⑧的气态氢化物,更稳定的是_____(写电子式)。
(3)原子半径:①_____⑥(填“>
(4)①~⑧的最高价氧化物对应的水化物中:酸性最强的是_____(填化学式,下同);碱性最强的是_______,具有两性的是_______。
(5)①的最高价氧化物对应的水化物与⑧的气态氢化物水溶液发生反应,其离子方程式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
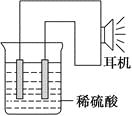
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用有机含碘![]() 主要以I2和IO3-的形式存在
主要以I2和IO3-的形式存在![]() 废水制备单质碘的实验流程如下:
废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的硫酸钠杂质。
下列说法正确的是( )
A.操作②中发生反应的离子方程式为IO3-+3SO32-=I-+3SO42-
B.操作①和③中的有机相从分液漏斗上端倒出
C.操作④为过滤
D.操作⑤可用如图所示的水浴装置进行

查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。

Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。

(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com