
科目: 来源: 题型:
【题目】用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 mL ,量取浓硫酸所用的量筒的规格是 。
(从下列中选用 A. 10mL B. 25mL C. 50mL D. 100ml)
(2)第③步实验的操作是
。
(3)第⑤步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面
查看答案和解析>>
科目: 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新型冠状病毒(2019-nCoV)有明显抑制作用;K为药物合成的中间体,其合成路线如图(A俗称石炭酸):

已知:①R—OH![]() R—Cl
R—Cl
②![]()
回答下列问题:
(1)有机物B的名称为__。
(2)I中官能团的名称为__。
(3)G到H的反应类型为__。
(4)由B生成C的化学反应方程式为__。
(5)E中含两个Cl原子,则E的结构简式为__。
(6)X是C的同分异构体,写出满足下列条件的X的结构简式__。(写出一种即可)
①苯环上含有硝基且苯环上只有一种氢原子;②1molX最多消耗2molNaOH。
(7)设计由苯甲醇为原料制备化合物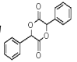 的合成路线___。(无机试剂任选。合成路线常用的表示方式为:A
的合成路线___。(无机试剂任选。合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,浓度均为1mol·L-1的两种气体X2和Y2,在恒容密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4mol·L-1,Y2的浓度为0.8mol·L-1,生成的Z的浓度为0.4mol·L-1,则该反应的化学方程式(Z用X、Y表示)是
A.X2+2Y2![]() 2XY2B.2X2+Y2
2XY2B.2X2+Y2![]() 2X2Y
2X2Y
C.X2+3Y2![]() 2XY3D.3X2+Y2
2XY3D.3X2+Y2![]() 2X3Y
2X3Y
查看答案和解析>>
科目: 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和S![]() 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
![]()
(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释______。
(2)“趁热过滤”时的温度应控制在______。
(3)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:_____________。
(4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,请你分析实际生产中是否可行:______,其理由是____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。
回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式__。第三电离能:Ca__Ti(填“大于”或“小于”)。
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是__。
②O3分子的中心原子杂化类型为___;与O3互为等电子体的是__(任意写一种)。
(3)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl![]() 2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dgcm3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于__位置。
②用a、d表示阿伏加德罗常数的值NA=__(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应的平衡常数Kp(100MPa)__Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为__(保留3位有效数字),Kp=__(MPa)-2(列出计算式)。
[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(3)科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极反应式为___。
②下列说法正确的是__(填标号)。
A.该装置用金(Au)作催化剂,目的是降低N2的键能
B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目: 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:

(1)装置(Ⅱ)中发生反应的化学方程式为 2Fe+3Br2 ═2FeBr3、________ 。
(2)实验开始时,关闭 K2、开启 K1和分液漏斗活塞,滴加苯和液溴的混合液, Ⅲ中小试管内苯的作用是___________。
(3)能说明苯与液溴发生了取代反应的现象是___________。
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法:___________ 。
(5)四个实验装置中能起到防倒吸作用的装置有___________。
(6)将装置(Ⅱ)反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液; ②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液; ④加入无水CaCl2粉末干燥;⑤________(填操作名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将反应2Fe3++Cu=2Fe2++Cu2+ 设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液。
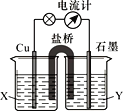
(1)石墨是电池的________极,X应选________溶液,Y应选___________________溶液。
(2)正极上的电极反应式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铬(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬的工艺流程如图:
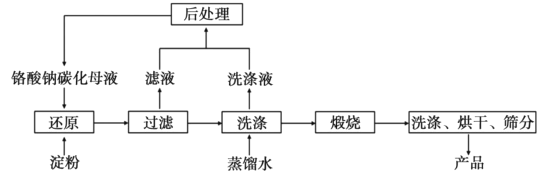
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液。
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式__。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是__(填标号)。
A.该反应一定无需加热即可进行
B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应
D.应建造废水回收池,回收含铬废水
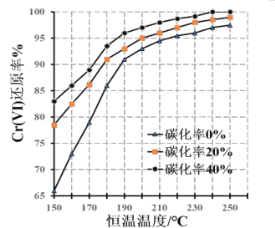
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_、__。
(4)滤液中所含溶质为__。该水热法制备氧化铬工艺的优点有__、__(写出两条即可)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[2Cr(OH)3H2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,失去质量与固体残留质量比为_。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组欲选用下列装置和药品制取纯净乙炔并进行乙炔性质的探究,试回答下列问题:
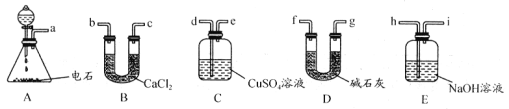
(1)A中制取乙炔的化学反应方程式为_________
(2)制乙炔时,旋开分液漏斗的活塞,使饱和食盐水缓慢滴下的原因是_______
(3)用电石制的乙炔中常含有 H2S、PH3 等杂质,除去杂质应选用____ (填序号,下同) 装置,气体应从____进;C 中通入含杂质的乙炔后有 Cu3P 沉淀、H3PO4 等生成,该反应化学方程式为_____________
(4)一种有机物 Y,与乙炔具有相同的最简式,其相对分子质量是 104。
①若该化合物 Y 分子的一氯代物只有一种且不能使溴水褪色,则 Y 的结构简式为________(用 “键线式”表示)。它的二氯代物有_____种同分异构体。
②前些年,化学家合作合成了一种新型炸药,该炸药分子可以看成是 Y 分子的四硝基(-NO2)取代物,分子结构非常对称,在核磁共振氢谱上观察到氢原子给出的峰只有一个,试画出其结构简式____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com