
科目: 来源: 题型:
【题目】已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化关系如图所示。下列说法正确的是
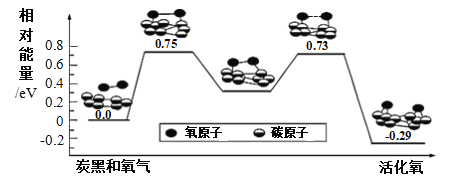
A.O2转化为活化氧与碳氧键生成无关
B.每活化1个O2分子最终吸收0.29 eV能量
C.该过程的最大能垒(活化能)E正= 0.73 eV
D.炭黑可加快SO2转化为SO3的反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B. 最外层电子数为ns2的元素都在元素周期表第2列
C. 处于最低能量的原子叫做基态原子,1s22s22![]() →1s22s22
→1s22s22![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
D. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】目前应用最广泛的氮氧化物脱除技术原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol。其他条件不变时,在2 L密闭容器中使用不同的催化剂X、Y、Z,产生n(N2)随时间的变化如下图所示。下列说法不正确的是
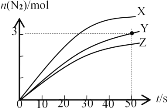
A.用催化剂X与Z,达到平衡时,N2产率一样
B.用催化剂Y前50 s平均反应速率v(NH3)=0.03 mol/(Ls)
C.分离出体系中的H2O(g)有利于提升氮氧化物的脱除率
D.若体系各物质状态保持不变,则反应在任何温度下均可自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家利用H2-N2生物燃料电池,以固氮酶为正极催化剂、氢化酶为负极催化剂,在室温条件下即实现合成NH3的同时还获得电能,其工作原理如下图所示:
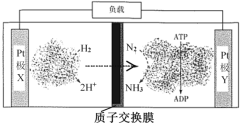
下列叙述不正确的是
A.该装置是将化学能转化为电能
B.正极反应:N2+6e-+6H+ = 2NH3
C.电池工作时H2在负极发生还原反应
D.电子沿X极板经导线向Y极板迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌。

(1)实验中要用玻璃棒搅拌的原因是________________;
(2)写出有关反应的化学方程式:________________,该反应__________(填“是”或“不是”)氧化还原反应。
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有_________________________。
(4)通过最后一个现象可以说明该反应为_________(填“吸”或“放”)热反应,这是由于反应物的总能量_________(填“大于”或“小于”)生成物的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图中的实验方案,不能达到相应实验目的是
A.对钢铁闸门防腐保护
B.除去CO2气体中混有的SO2
C.验证CH3CH2Br与NaOH乙醇溶液共热产物有乙烯生成
D.验证CuSO4对H2O2分解反应有催化作用
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。已知下列数据:
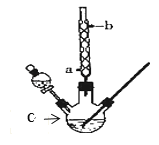
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
请回答下列问题:
(1)仪器C的名称为______,球形冷凝管的作用是_____。
(2)向C中加入反应物,待充分反应后,将C中的混合物倒入装有饱和碳酸钠溶液的烧杯中充分振荡洗涤。饱和碳酸钠溶液作用是(填字母):_____
A.中和乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(3)经多次振荡洗涤、静置分液后,为了进一步提纯乙酸乙酯,可采用蒸馏的方法,蒸馏时控制温度在__左右,温度计的水银球应位于____。
(4)若实验所用乙酸质量为2.4g,乙醇质量为2.1g,得到纯净的产品质量为2.64g,则乙酸乙酯的产率是______。
(5)乙酸乙酯与氢氧化钠溶液发生反应的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式或化学方程式正确的是
A.用CuSO4溶液除去乙炔中的H2S:S2-+ Cu2+ = CuS ↓
B.某种火箭发射逸出的N2O4变红棕色:N2O4 ![]() 2NO2
2NO2
C.Na2O2用于呼吸面具供氧:Na2O2+H2O = 2NaOH+O2↑
D.CuSO4溶液中加入过量氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

(1)氢氧燃料电池的在导线中电流的方向为由______(用a、b表示)。
(2)负极反应式为______,正极反应式为___________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ 2Li+H2![]() 2LiH Ⅱ LiH+H2O=LiOH+H2↑
2LiH Ⅱ LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是_________,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com