
科目: 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目: 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列相关说法错误的是( )
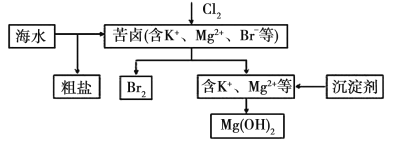
A.将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2
B.可以通过物理方法从海水中得到粗盐
C.生产中用NaOH作为沉淀剂获得Mg(OH)2
D.用空气和水蒸气吹出单质溴,再用SO2将其还原吸收,以达到富集溴的目的
查看答案和解析>>
科目: 来源: 题型:
【题目】向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并灼烧,得到固体剩余物质的组成可能是( )
A.NaCl、NaBr、Na2SO4B.NaCl、Na2SO4、Br2
C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡:Cr2O72-+H2O ![]() 2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
| 序号 | 试剂X |
ⅰ | 1 mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是______(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是____________,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为___________ 。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
① 方案一:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式__________。
② 请你设计方案二:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2是大气中的有害物质,需要对其进行综合治理和利用。
(1)工业上常用氨水吸收法处理SO2,可生成(NH4)2SO3或NH4HSO3。
① (NH4)2SO3显碱性,用化学平衡原理解释其原因:____________。
② NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是____(填字母)。
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)> c(H+)=c(OH-)
c.c(NH4+)+c(H+)=c(SO32-) +c(HSO3-)+c(OH-)
(2)某工厂烟气中主要含SO2、CO2,在较高温度经下图所示方法脱除SO2,可制得H2SO4。
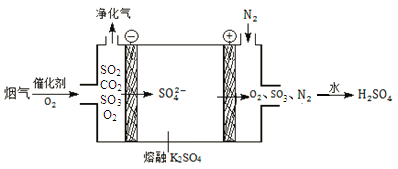
①在阴极放电的物质是_______。
②在阳极生成SO3的电极反应式是______。
(2)检测烟气中SO2脱除率的步骤如下:
a.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
b.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
c.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示a中溴水的主要作用________________。
②若沉淀的质量越大,说明SO2的脱除率越_____(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示仪器(内含物质)组装成实验装置,可验证木炭与浓H2SO4反应生成CO2,下列有关说法正确的是( )
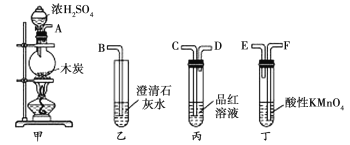
A.上述装置连接的正确顺序是A→E→F→C→D→B
B.SO2和CO2都可与澄清石灰水反应,且原理相同
C.只需观察到乙中澄清石灰水变浑浊这一个现象,即可验证生成CO2
D.将SO2通入酸性高锰酸钾溶液,溶液褪色,体现SO2的漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
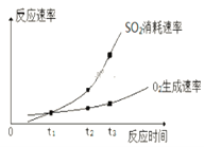
①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。
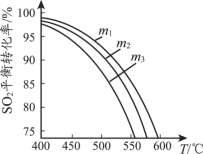
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物是中学化学中常见的物质。
(1)铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作________(填 “阳”或“阴”)极,铜离子向________极移动,阴极的电极反应式为________。
(2)常温时,FeCl3溶液pH<7,原因是(用离子方程式表示)________。
(3)将0.1mol·L-1 FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A.非金属性强弱顺序为:W>Q>Y
B.元素X与元素Z的最高正化合价之和的数值等于8
C.Z单质和W的最高价氧化物对应的水化物浓溶液不反应
D.电解熔融ZQ3可以制备Z的单质
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
② 通过物质所含能量计算。已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为E A、EB、 EC、 ED,该反应△H=_______。
③ 通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2 (g) =Na2O(s) △H=-414kJ·mol-1
O2 (g) =Na2O(s) △H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1NaOH溶液
C.1.0 g NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com