
科目: 来源: 题型:
【题目】实验室常用氟化钙固体和浓硫酸混合加热制HF:CaF2+H2SO4(浓)![]() CaSO4+2HF↑。下列关于该反应的说法错误的是
CaSO4+2HF↑。下列关于该反应的说法错误的是
A.该反应利用了浓硫酸的酸性和难挥发性
B.CaF2晶体中Ca2+和F-的配位数之比为1:2
C.影响H2SO4和CaSO4熔点的作用力不同
D.HF是极性分子且分子极性强于HC1
查看答案和解析>>
科目: 来源: 题型:
【题目】 (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________,A电极的电极反应式为____________;反应进行一段时间后溶液C的酸性会____(填“增强”“减弱”或“基本不变”)。
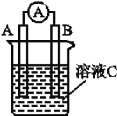
(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______(填化学名称),负极反应为___________;正极反应为_________。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-![]() 4CO2,则正极反应式为_____,电池总反应式为______。
4CO2,则正极反应式为_____,电池总反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】检验并提取海带中碘的实验中涉及多种基本实验操作,下列相关叙述正确的是
A.灼烧海带时要用到蒸发皿、酒精灯等仪器
B.海带灰溶解和过滤的操作都要用到玻璃棒且作用不同
C.氧化I-时用浓硝酸代替稀硫酸和H2O2溶液效果更好
D.用CCl4萃取I2后要进行分液,有机层从分液漏斗上口倒出
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
1L | 2L | 4L | |
100℃ | 1.00mol/L | 0.75mol/L | 0.53mol/L |
200℃ | 1.20mol/L | 0.90mol/L | 0.63mol/L |
300℃ | 1.30mol/L | 1.00mol/L | 0.70mol/L |
下列说法正确的是( )
A.温度不变,压强增大,Y的质量分数减少
B.体积不变,温度升高,平衡向逆反应方向移动
C.m>n
D.Q<0
查看答案和解析>>
科目: 来源: 题型:
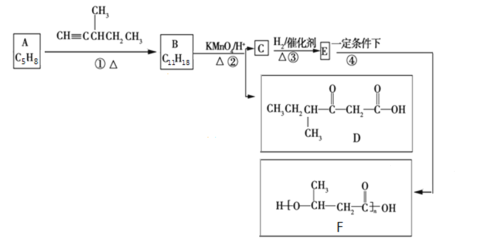
【题目】有机物A是天然橡胶的单体。有机物F是一种环保型塑料,一种合成路线如图所示:
已知:
①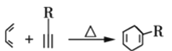
②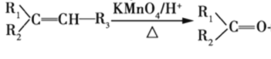 +R3-COOH(—R1、—R2、—R3、—R均为烃基)
+R3-COOH(—R1、—R2、—R3、—R均为烃基)
请回容下列问题:
(1)A用系统命名法命名为__________________________。
(2)A分子与Cl2分子发生1:1加成时,其产物种类有____________种(不考虑立体异构)。
(3)B与足量H2反应后的产物的结构简式为![]() ,则B的结构简式为___________________,1个B分子中有________个手性碳原子。
,则B的结构简式为___________________,1个B分子中有________个手性碳原子。
(4)C分子中的官能团名称为_____________________。
(5)写出反应④的化学方程式:______________________________________________________。
(6)G是C的同分异构体,G能发生水解反应和银镜反应,1个G分子中含有2个碳氧双键,则G的可能结构共有___________种(不考虑立体异构)。
(7)设计由有机物D和甲醇为起始原料制备CH3CH2CH(CH3)CH =CHCOOCH3的合成路线______________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,如图表示在不同反应时间(t)时,温度(T)和压强(P)与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,如图表示在不同反应时间(t)时,温度(T)和压强(P)与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2,P1>P2,m+n>p,放热反应B.T1>T2,P 1<P2,m+n>p,吸热反应
C.T1<T2,P1>P2,m+n<p,放热反应D.T1>T2,P1<P2,m+n<p,吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知研究氮及其化合物的转化对于环境改善有重大意义。
I.已知N2(g) +O2(g)=2NO(g) △H=+180.4 kJ/mol,
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H=![]() kJ/mol。
kJ/mol。
(1)用NH3消除NO污染的反应为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
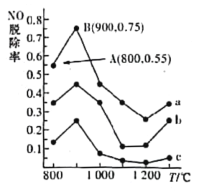
(2)不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。曲线a中NH3的起始浓度为4×10- 5mol/L,从A点到B点经过2秒,该时间段内NO的脱除速率为_______mg/(L·s),在AB所在的曲线上当温度高于900℃时NO脱除率明显降低的原因是_______________________________________________。
Ⅱ.用活性碳还原法也可以处理氮氧化合物,发生的反应为2CO(g)+ 2NO(g)![]() N2(g)+2CO2(g) △H=-746.8kJ/mol。
N2(g)+2CO2(g) △H=-746.8kJ/mol。
(3)在一恒容绝热的密闭容器中,能表示上述反应达到平衡状态的是_____________(填字母代号)。
A.单位时间内断裂1 mol N≡N键的同时生成2 mol C=O键
B.容器内的总压强保持不变
C.混合气体的密度保持不变
D.c(NO):c(N2):c(CO2)=2:1:2
E.混合气体的平均摩尔质量保持不变
(4)向一恒容密闭容器中充入3mol CO和2mol NO,测得气体的总压为10MPa,在一定温度下开始反应,10 min后达到平衡,测得NO的转化率为75%,该反应的平衡常数KP=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。
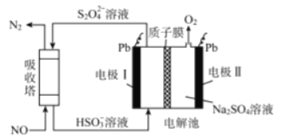
(5)写出吸收塔中的离子反应方程式_____________________________________,反应过程中若通过质子交换膜的H+为1 mol时,吸收塔中生成的气体在标准状况下的体积为_____ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含Ce[ CO3]F)为原料制备CeO2的一种工艺流程如图所示:
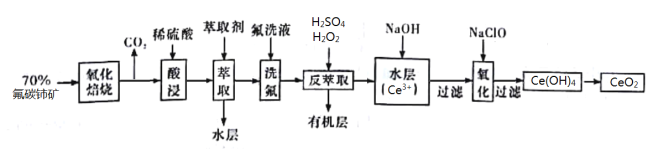
已知:①Ce4+能与F![]() 结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能;
③Ksp[Ce(OH)3]=1×10-20。
回答下列问题:
(1)Ce[CO3]F中铈元素的化合价为___________,H2O2分子的结构式为____________________。
(2)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是____________________________________。
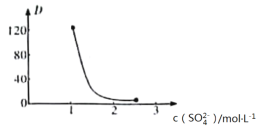
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。下图所示中,D是分配比,表示Ce(Ⅳ)分别在有机层与水层中存在形式的物质的量浓度之比,即c[Ce·(H2n-4A2n)]与c[(CeSO4)2+]的比值。加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因为__________________________________________________。
Ce·(H2n-4A2n)+4H+。下图所示中,D是分配比,表示Ce(Ⅳ)分别在有机层与水层中存在形式的物质的量浓度之比,即c[Ce·(H2n-4A2n)]与c[(CeSO4)2+]的比值。加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因为__________________________________________________。
(4)“反萃取”中,实验室用到的主要玻璃仪器名称为___________;在H2SO4,和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有2molH2O2参加反应,转移电子的物质的量为_____________。为使Ce3+完全沉淀,应加入NaOH调节pH为_________。(溶液中c(Ce3+)小于1.0×10-5molL-1时,可认为Ce3+沉淀完全)
(5)“氧化”步骤的化学方程式为_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com