
科目: 来源: 题型:
【题目】用酸性KMnO4溶液与H2C2O4(草酸)溶液反应研究影响反应速率的因素,一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图所示:
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |

(1)写出该反应的离子方程式__________________________________________。
(2)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是______>______(填实验序号)。
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=______ mol·L-1(假设混合溶液的体积为50mL)。
(4)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_________________________来比较化学反应速率。
(5)小组同学发现反应速率变化如图,其中t1-t2时间内速率变快的主要原因可能是:①反应放热,②___________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(2)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
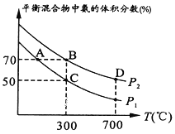
①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.相同时间内,断开H-H键的数目和生成N-H键的数目相同
D.容器内气体浓度c(N2):c(H2):c (NH3)=1:3:2
②P1_____P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:C点______B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
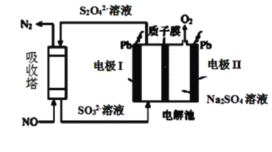
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJmol-1。
CH3OH(g) △H= -90.8kJmol-1。
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,以CH3OH表示该过程的反应速率v(CH3OH)=______。
②要提高反应2H2(g)+CO(g)CH3OH(g)中CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.加入惰性气体 f.分离出甲醇
(2)①氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是酸性燃料电池,则正极反应方程式是____________。
②科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为__________。
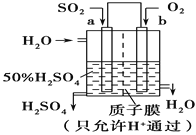
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NH4NO3的分解产物与温度有关:
NH4NO3![]() NH3↑+HNO3↑①
NH3↑+HNO3↑①
NH4NO3![]() N2O↑+2H2O↑②
N2O↑+2H2O↑②
2NH4NO3![]() 2N2↑+O2↑+4X↑③
2N2↑+O2↑+4X↑③
4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑④
3N2↑+2NO2↑+8H2O↑④
下列说法错误的是
A.四个反应中有三个是氧化还原反应
B.反应②所得混合气体的相对分子质量是26.7
C.反应③中X的化学式是H2O
D.反应④的氧化产物是N2,还原产物是NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向NaHS溶液中加入盐酸产生大量气泡 | 氯的非金属性强于硫 |
B | 向溶液中加盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液中一定含 |
C | 将铁片和铜片用导线连接后插入浓硝酸,铁片表面产生气泡 | 铜的活泼性强于铁 |
D | 常温下测得CH3COONH4溶液pH=7 | 相同温度下CH3COOH和NH3·H2O电离常数相同 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学——选修5:有机化学基础)(15分)
有机化合物G是合成维生素类药物的中间体,其结构简式如图所示

G的合成路线如下图所示:

其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知:
请回答下列问题:
(1)G的分子式是 ,G中官能团的名称是 ;
(2)第②步反应的化学方程式是 ;
(3)B的名称(系统命名)是 ;
(4)第②~⑥步反应中属于取代反应的有 (填步骤编号);
(5)第④步反应的化学方程式是 ;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式 。
①只含一种官能团;②链状结构且无-O-O-;③核磁共振氢谱只有2种峰。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为: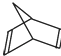
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A.32g18O3中含有的质子数目为16NA
B.1LpH=2的HF溶液中所含的H+和F-的数目均为0.01NA
C.2.3gNa与一定量的氧气反应后所得固体质量为2.8g,转移电子数目为0.1NA
D.16gCH4与氯气光照完全反应生成氯代烃的分子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com