
科目: 来源: 题型:
【题目】下列叙述错误的是( )
A.一定条件下的可逆反应达到限度时,此条件下反应物的转化率最大
B.化学反应限度的大小主要取决于反应物的性质,且随条件的改变而改变
C.化学反应限度随外界条件的改变而改变的根本原因是外界条件的改变引起v正≠v逆
D.可逆反应的正反应的限度大,正反应的速率就大
查看答案和解析>>
科目: 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新型冠状病毒感染者有潜在的治疗效果:K为药物合成的中间体,其合成路线如图所示:
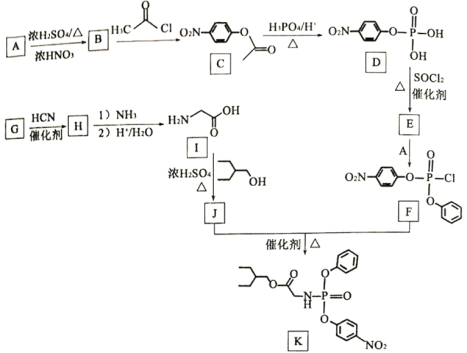
已知以下信息
①![]()
②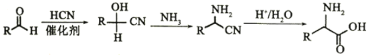
回答下列问题:
(1)B的化学名称为____________。
(2)J中含有官能团的名称为____________。
(3)由B生成C的反应类型为____________。
(4)由G生成H的化学反应方程式____________。
(5)E中含两个Cl原子,则E的结构简式____________。
(6)X是C的同分异构体,写出任意一个满足下列条件的X的结构简式____________。
①苯环上含有硝基且苯环上只有一种氢原子;
②遇FeCl3溶液发生显色反应:
③1mol的X与足量金属Na反应可生成2gH2。
(7)设计由苯甲醇(![]() )为原料合成化合物
)为原料合成化合物![]() 的路线____________(其他试剂任选)。
的路线____________(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为__________。
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式 __________________________
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:
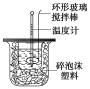
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__________
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒上下轻轻地抽动
(3)实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①根据表中数据计算出来温度差的平均值为______℃;
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_______( 取小数点后一位)。
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是____。
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目: 来源: 题型:
【题目】氮(N)、硝(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)基态砷原子的价电子排布图为________________,第三周期元素的原子中,第一电离能大于磷原子的有________________种。
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有________________(填序号)。
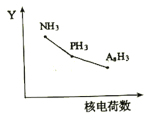
A.稳定性B.沸点时C.R-H键之间的键角D.分子间作用力E.还原性
(3)经测定发现,某种N2O5固体由NO2+和NO3-两种离子组成,阳离子中N原子的杂化方式是________________杂化,阴离子的空间构型为________________。
(4)乙二胺(H2N-CH2-CH2-NH2)与CuCl2溶液可形成配离子(结构如图)。
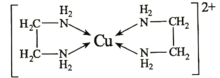
Cu2+的配位数为________________,1mol该配离子中含σ键为________________mol,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是________________。
(5)通常认为Cu3N是离子晶体,其晶格能可通过图1的Born-Haber循环计算得到。通过图1中数据________________(填“能”或“不能”)计算出Cu原子的第一电离能,Cu3N晶格能为________________kJ·mol-1。
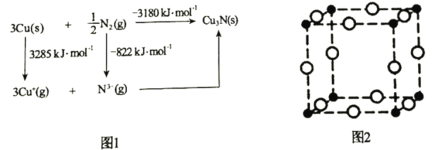
(6)Cu3N晶胞如图2所示,Cu+的半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为________________g·cm-3(列出计算式即可,阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
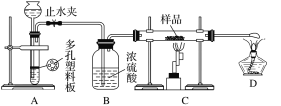
(1)仪器组装完成后,夹好止水夹,__________________________________,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________(填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 ______。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________,写出产生上述气体的化学方程式:____________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:I.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II.相关金属离子形成氢氧化物沉淀的pH范围:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
回答下列问题:
(1)滤渣②的成分是________________。
(2)写出“氧化”步骤中反应的化学方程式________________。
(3)“加热”操作的目的是________________。
(4)根据平衡移动原理解释酸化至pH=1的目的是________________(用离子方程式和适当文字说明)。
(5)通过下列实验可测定产品中K2Cr2O7(M=294g/mol)的纯度:称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(Cr2O72-的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/LNa2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。则所测定产品中K2Cr2O7的纯度为________________。
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。

①负极的电极反应式为________________;
②一段时间后,中间室NaCl溶液的浓度________________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
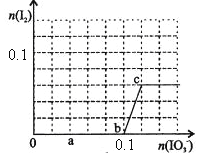
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各选项中,物质之间通过一步反应就能实现如图所示变化的是( )
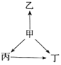
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com