
科目: 来源: 题型:
【题目】青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是

A. 维生素C中含有3种官能团
B. 维生素C分子式为C6H8O6
C. 维生素C能使酸性高锰酸钾溶液褪色
D. 维生素C在碱性溶液中能稳定存在
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为ABC三套实验装置。
A、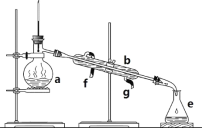 B、
B、 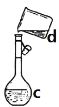 C、
C、 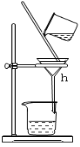
(1)写出下列仪器的名称:b.___, c._____,h.____。
(2)仪器a~e中,使用前必须检查是否漏水的有_____。(填序号)
(3)若利用装置分离酒精和水的混合物,还缺少的仪器是_____,将仪器补充完整后进行实验,冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,B装置是某同学转移溶液的示意图。
① B 图中的错误是_____。
② 根据计算得知,所需NaOH的质量为_______。
③ 配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作_______;容量瓶用蒸馏洗涤后残留有少量的水_________;若定容时俯视刻度线_______。
(6)将(4)所配溶液滴入盛有硫酸铜溶液试管中,可以观察到现象是_____,发生反应的离子方程式为_______,若将得到混合物进行分离,可选用分离方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业的原理示意图如图。下列说法正确的是
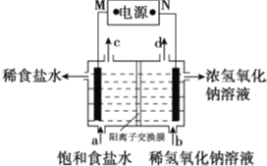
A. M为负极
B. 通电使氯化钠发生电离
C. 出口c收集到的物质是氯气
D. 通电一段时间后,阴极区pH降低
查看答案和解析>>
科目: 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目: 来源: 题型:
【题目】Cr、Co、Al的合金及其相关化合物用途非常广泛。
(1) Cr3+基态核外电子排布式为___________。
(2)1951年Tsao最早报道用LiAlH4还原腈,如反应: 。
。
①LiAlH4中三种元素的电负性从大到小的顺序为___________。
②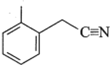 分子中碳原子的轨道杂化类型为__________,1mol该分子中含σ键的物质的量为__________。
分子中碳原子的轨道杂化类型为__________,1mol该分子中含σ键的物质的量为__________。
(3) [Co(15-冠-5)(H2O)2]2+是一种配位离子(“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5),请在该配位离子结构示意图(图-1)中的相应位置补画出配位键____________。
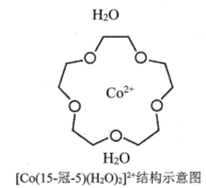 图1
图1
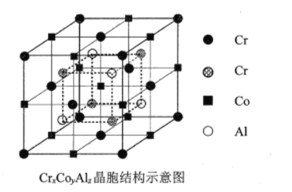 图2
图2
(4)全惠斯勒合金CrxCoyAlz的晶胞结构如题图-2所示,则其化学式为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
(1)铝的冶炼、提纯的方法很多。
①高温碳热歧化氯化法冶铝包含的反应之一为:Al2O3(s)+AlCl3(g)+3C(s)![]() 3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
②碳热还原Al2O3冶铝的部分反应如下:
Ⅰ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1=akJ/mol
Ⅱ. 4Al2O3(s)+Al4C3(s)=3Al4O4C(s) △H2=bkJ/mol
Ⅲ. Al4O4C(s)+Al4C3(s)=8Al(g)+4CO(g) △H3=ckJ/mol
反应Al2O3(s)+3C(s)=2Al(g)+3CO(g)的△H=__________kJ/mol
③用离子液体AICb-BMIC(阳离子为EMIM+、阴离子为AlCl4-、Al2Cl7-)作电解质,可实现电解精炼铝。粗铝与外电源的_____________极(填“正”或“负")相连;工作时,阴极的电极反应式为_______________。
(2)真空条件及1173K时,可用铝热还原Li5AlO4制备金属锂(气态),写出该反应的化学方程式:__________________________。
(3)用Al、Fe或Al-Fe合金还原脱除水体中的硝态氮(NO3--N),在45℃,起始c(KNO3-N)为50mg·L-1、维持溶液呈中性并通入Ar等条件下进行脱除实验。结果如图所示(c0为起始浓度、c为剩余浓度):
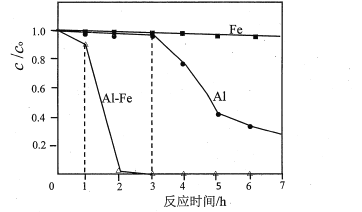
①纯Al在0~3h时,NO3-几乎没有被脱除,其原因是_______________________;写出3h后NO3-被还原为N2的离子方程式:____________________________。
②Al-Fe合金1~2h比纯A13~4h的脱除速率快得多的可能原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求,回答下列问题:
(1)写出离子反应方程式“Ba2+ + SO![]() = BaSO4↓”对应的化学反应方程式__________。
= BaSO4↓”对应的化学反应方程式__________。
(2)反应“2Na + O2 ![]() Na2O2”,氧化产物是____;产物中O的化合价为__。
Na2O2”,氧化产物是____;产物中O的化合价为__。
(3)维生素C 又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C 具有_____。(填氧化性或还原性)
(4)某混合物中可能含有可溶性硫酸盐、碳酸盐及硝酸盐。为了检验其中是否含有硫酸盐,某同学取少量混合物溶于水后,向其中加入_____溶液,再加入______溶液发现有白色沉淀生成,并由此得出该混合物中含有硫酸盐的结论。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有500 mL 1 mol·L-1的H2SO4溶液,下列操作及结论正确的是
A.取出50mL该溶液,其中c(SO![]() )=0.1 mol·L-1
)=0.1 mol·L-1
B.取出50mL该溶液,加入足量的BaCl2溶液,完全反应,可得11.65gBaSO4沉淀
C.取出100mL该溶液,加入足量的锌粒,充分反应,所得气体的体积为2.24L
D.取出50mL该溶液,加蒸馏水配制成100 mL溶液,c(H+)=2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com