
科目: 来源: 题型:
【题目】药物M(Rolumilast)能用于慢性阻塞性肺病的治疗,其一种合成路线如图:
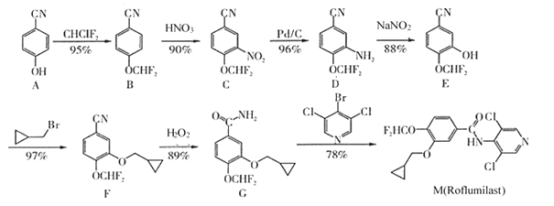
注:箭头下的百分数为每步反应的产率。
(1)化合物A中含氧官能团的名称是__;B→C的反应类型为__。
(2)由E→F的化学方程式为__。
(3)在G→M的过程中,若使用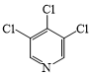 代替
代替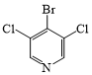 ,则M的产率会由78%降至48%,其原因除了氯原子的反应活性比溴原子低外,还可能是__。
,则M的产率会由78%降至48%,其原因除了氯原子的反应活性比溴原子低外,还可能是__。
(4)按上述合成路线,若投入0.01mol化合物D参与反应,最终获得化合物F(摩尔质量:239g·mol-1)的质量为___g。
(5)化合物M的另一种合成路线如图:
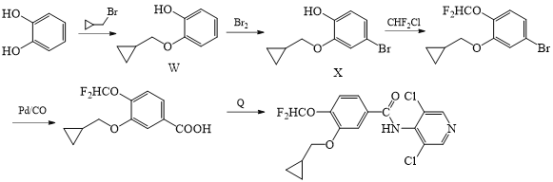
回答下列问题:
①化合物X的分子式为__。
②写出化合物Q的结构简式__。
③写出同时符合下列条件的化合物W的同分异构体的__(写出一种即可)。
Ⅰ.能与FeCl3溶液发生显色反应
Ⅱ.苯环上的一氯代物只有一种
Ⅲ.核磁共振氢谱有5组峰且峰面积之比为1:1:2:2:6
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
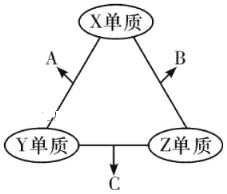
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是
A.分子式为C5H10的烯烃B.甲苯的一氯代物
C.相对分子质量为74的一元醇D.立方烷(![]() )的二硝基取代物
)的二硝基取代物
查看答案和解析>>
科目: 来源: 题型:
【题目】镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
(1)某蓄电池反应为2NiO(OH)+Cd+2H2O![]() Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
(2)镍的羰化反应为:Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH。
Ni(CO)4(g) ΔH。
①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,5s后测得Ni(CO)4的物质的量为1.5mol,则0~5s内平均反应速率v(CO)=__mol·L·s-1。
②该反应的平衡常数K随温度升高而减小,则该反应的ΔH__0(填“>”或“<")。
(3)NiSO4·6H2O晶体是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料制取。制取步骤如下:
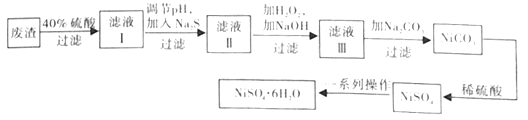
①在实验室中,欲用98%的浓硫酸(密度1.84g·mL-1)配制40%的稀硫酸,需要的玻璃仪器除玻璃棒外,还有__。
②向滤液Ⅰ中加入Na2S的目的是_。(已知:Ksp[FeS]=6.3×10-18,Ksp[CuS]=1.3×10-36,Ksp[ZnS]=1.3×10-24,Ksp[NiS]=1.1×10-21)
③滤液Ⅲ中所含的阳离子主要有__。
④NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为__。
⑤在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是__(写出一条即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】低浓度的氢氟酸是一元弱酸,存在下列两个平衡:HF![]() H++F-,HF+F-
H++F-,HF+F-![]() HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
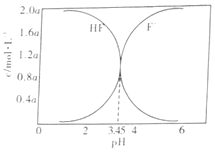
A.c(HF)+c(F-)=2.0amol·L-1
B.c(F-)>c(HF)时,溶液一定呈碱性
C.随着溶液pH增大,![]() 不断增大
不断增大
D.25℃时,HF的电离常数Ka=10-3.45
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组同学探究稀H2SO4对溶液中的I—被O2 氧化的影响因素。
(1)为了探究c(H+)对反应速率的影响,进行实验:
10mL 1mol· L-1 KI溶液5滴淀粉溶液 | 序号 | 加入试剂 | 变色时间 |
Ⅰ | 10mL蒸馏水 | 长时间放置,未见明显变化 | |
Ⅱ | 10mL 0.1mol· L-1H2SO4溶液 | 放置3min后,溶液变蓝 | |
Ⅲ | 10mL 0.2mol· L-1H2SO4溶液 | 放置1min后,溶液变蓝 | |
Ⅳ | 10mL 0.1mol· L-1K2SO4溶液 | 长时间放置,未见明显变化 |
① 写出实验Ⅱ发生反应的离子方程式 ______。
② 实验Ⅰ~Ⅲ所得结论:_______。
③ 增大实验Ⅱ反应速率还可以采取的措施 ______。
④ 实验Ⅳ的作用是______。
(2)为探究c(H+)除了对反应速率影响外,是否还有其他影响,提出假设:
ⅰ. 增大c(H+),增强O2的氧化性;
ⅱ. 增大c(H+),_______。
小组同学利用下图装置设计实验方案,对假设进行验证。
| 序号 | 溶液a | 溶液b | 现象 |
Ⅴ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 | |
Ⅵ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 1mL 0.2mol·L-1H2SO4溶液 9mL H2O | 指针 偏转 | |
Ⅶ | X | 10mL 0.1mol·L-1K2SO4溶液 10mL 0.2mol·L-1H2SO4溶液 | Y | |
Ⅷ | Z | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 |
通过实验证实假设ⅰ合理,将表中空白处的试剂或现象补充完整。
X __________;Y _________;Z __________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
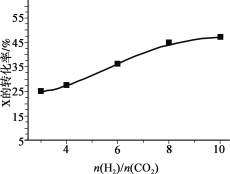
① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组尝试在钢制钥匙上镀铜。
实验I:将钥匙直接浸入0.4 mol·L-1 CuCl2溶液中,20s后取出,钥匙表面变红,但镀层疏松,用纸即可擦掉。
实验II:用图装置对钥匙进行电镀铜。钥匙表面迅速变红,同时有细小气泡产生,精铜表面出现少量白色固体。30s后取出钥匙检验,镀层相对实验I略好,但仍能用纸巾擦掉一部分。经调整实验条件后获得了较好的电镀产品。
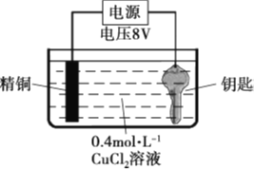
实验III:用0.4 mol·L-1 CuSO4溶液代替CuCl2溶液重复实验II,精铜表面未出现白色固体。
回答下列问题:
(1)实验I反应的化学方程式是_______。
(2)实验II中钥匙应与电源的_______极连接。
(3)钥匙表面产生的气体是_______。
(4)为了避免实验III中钥匙表面产生气体,应该采取的措施是________。
(5)常见化合物中铜元素有+1、+2两种价态,结合实验III推测实验II中精铜表面产生的白色固体的电极反应式是________。(已知CuOH是一种难溶于水的黄色固体)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,可用作LED的基质材料,通过等离子法由SiH4(沸点-111.9℃)与氨气反应制取的方程式如下:3SiH4+4NH3=Si3N4+12H2。设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1.8gSiH4所含质子的数目为3.2NA
B.标准状况下,4.48LNH3和H2的混合气体所含分子总数为0.2NA
C.NA个NH3分子溶于1L的水,所得溶液的物质的量浓度为1mol·L-1
D.当生成1molSi3N4时,转移电子数目为6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】钾(K)资源丰富,成本低廉,用其制作的钾离子电池有着超越锂离子电池的发展前景。我国科研人员在钾离子电池的研发上做出了巨大的贡献。如图是我国某科研团队研制的一种钾离子电池充电时的示意图,下列说法不正确的是( )
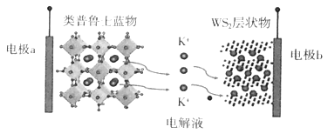
A.放电时,外电路电子由电极a流向电极b
B.钾离子电池电解液一般选择有机溶剂,但会有一定的安全隐患
C.充电时,每当外电路中转移1mole-,正极材料会“释放”39gK+
D.充电时,电极b上的电极反应式为:WS2+xK++xe-=KxWS2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com