
科目: 来源: 题型:
【题目】在100mL 0.10 mol·L-1的 AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是( )
A. 最终得到白色沉淀和无色溶液
B. 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C. 在最终得到的溶液中,Cl—的物质的最为0.02 mol
D. 在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
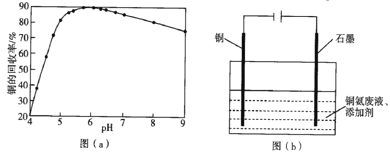
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Fe+CuSO4===FeSO4+Cu B. NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C. Cl2+H2O![]() HCl+HClO D. Fe2O3+3CO
HCl+HClO D. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L
②0.5 mol H2所占体积为11.2 L
③标准状况下,1 mol H2O的体积为22.4 L
④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L
⑤各种气体的气体摩尔体积都约为22.4 L·mol-1
⑥标准状况下,体积相同的气体的分子数相同
A. ①③⑤B. ④⑥C. ②④⑥D. ①④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程的离子方程式书写正确的是( )
A.Cu与AgNO3溶液反应: Cu + Ag+![]() Ag + Cu2+
Ag + Cu2+
B.醋酸与氢氧化钠溶液反应: CH3COOH + OH![]() CH3COO + H2O
CH3COO + H2O
C.碳酸氢钠与硫酸反应: CO32 + 2H+![]() CO2↑ + H2O
CO2↑ + H2O
D.氢氧化铁胶体的制备:Fe2+ + 3H2O ![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
查看答案和解析>>
科目: 来源: 题型:
【题目】化学小组为探究![]() 在酸性
在酸性![]() 溶液中的反应,利用如图装置进行实验:
溶液中的反应,利用如图装置进行实验:
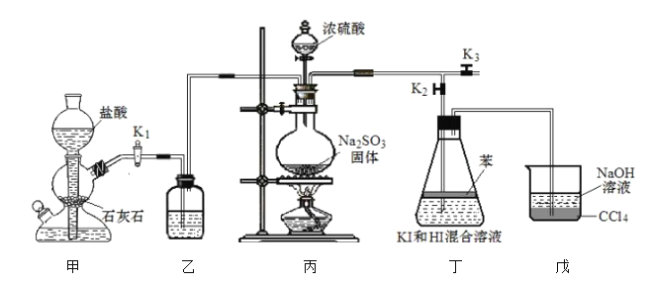
I.排出装置内的空气。减缓![]() 的流速,向丁装置中通入
的流速,向丁装置中通入![]() 和
和![]() 的混合气体。
的混合气体。
Ⅱ.一段时间后,溶液变黄并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入![]() 和
和![]() 混合气体,溶液变为无色。
混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
回答下列问题:
(1)苯的作用为__________。排出装置内空气的具体操作为_________。
(2)向装置丁中缓慢通入![]() 的作用是__________。
的作用是__________。
(3)步骤Ⅱ反应的离子方程式为__________;步骤Ⅲ反应的离子方程式为______________。
(4)实验的总反应为_________,![]() 和
和![]() 在反应中的作用为___________。
在反应中的作用为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的质子数为NA
C. 常温常压下,46gNO2含有的原子总数为3NA
D. 标况下,4.48LH2O中含有氢原子数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。

⑴基态硼原子的电子排布式为______________________________。
⑵ 关于这两种晶体的说法,正确的是_________________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是______________________________。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为___________________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________。
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_____________mol配位键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com