
科目: 来源: 题型:
【题目】(1)已知由金属钠制得氧化钠,可用多种方法:a.4Na+O2===2Na2O,b.4Na+CO2===2Na2O+C,c.2NaNO2+6Na===4Na2O+N2↑。
①在上述三种方法中,最好的方法是________(填序号),原因是________________。
②上述反应c中NaNO2作________剂,当有1 mol NaNO2反应时,电子转移的数目是________________________________________________________________________。
(2)现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):
①装置Ⅳ中盛放的药品是________,其作用是____________________________。


②若规定气体的气流方向从左到右,则组合实验装置时各仪器接口的标号字母(a、b……)顺序:空气进入________,________接________,________接________,________接________。
③装置Ⅱ的作用____________________________________________________。
④操作中通空气和加热的顺序为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
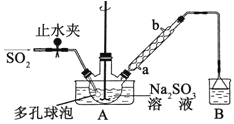
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,搅拌(防止生成沉淀覆盖在锌粉表面阻止反应进行),反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
⑴装置B 的烧杯中应加入的溶液是__________________________________________。
⑵A中多孔球泡的作用是_______________________________________________。
⑶冷凝管中回流的主要物质除H2O 外还有__________________________(填化学式)。
⑷写出步骤2中发生反应的化学方程式____________________________。
⑸步骤3中在真空容器中蒸发浓缩的原因是__________________________________。
⑹①抽滤时使用如下装置,其中a和b的名称分别__________、 __________。中途停止抽滤时应 ___________________________以防倒吸。
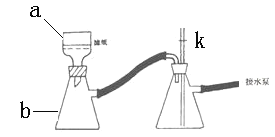
②如果抽滤的溶液具有强氧化性时,可采取_________________________________的措施
⑺为了测定产品的纯度,准确称取2.000g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示得出的结论不正确的是( )
A.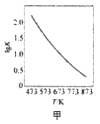 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.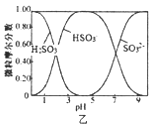 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C. 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.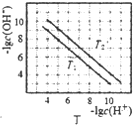 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
查看答案和解析>>
科目: 来源: 题型:
【题目】用离子方程式(不能用离子方程式的用化学方程式)解释下列实验事实
⑴用纸层析法分离Fe3+、Cu2+时,氨熏显色后出现蓝色斑点_______________________________________________________________________ 。
⑵用新制的氢氧化铜检验牙膏中的甘油______________________________________________________________________ 。
⑶用AgNO3溶液、稀硝酸和NaNO2溶液直接检验火柴头中的氯元素_______________________________________________________________________ 。
⑷用水杨酸和乙酸酐在酸性条件下制备阿司匹林________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液X中可能含有Na+、Fe3+、Mg2+、HCO3-、Cl-、SO42-、SO32-中的若干种,所含离子的物质的量浓度均相同,为了确定该溶液的组成,某同学取100mL上述溶液X,进行如下实验:
![]()
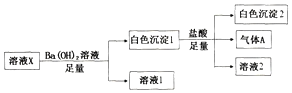
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在Na+、Mg2+、HCO3-、SO42-
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在-Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图中的实验,能达到实验目的的是
A | B | C | D | |
实验方案 |
|
|
|
|
实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 除去SO2中的少量HCl | 准确量取20.00mL体积K2Cr2O7标准溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
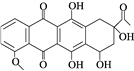
A. 每个柔红酮分子中含有2个手性碳原子
B. 柔红酮分子中所有的碳原子都在同一个平面上
C. 1 mol柔红酮最多可与2 mol Br2发生取代反应
D. 一定条件下柔红酮可发生氧化、加成、消去反应
查看答案和解析>>
科目: 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:_______________________。
(4)请配平以下化学方程式:
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com