
科目: 来源: 题型:
【题目】下列说法正确的是
A.用药匙取用粉末状或小颗粒状固体
B.pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿
C.蒸馏时蒸馏烧瓶中的液体尽量多些,加沸石进行蒸馏,但液体也不能蒸干
D.分液时下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
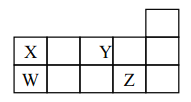
A. 四种元素中原子半径最大为 W, Y 的氢化物稳定性最强
B. 四种元素最高价氧化物的水化物都是酸
C. XZ4、 WY2中所含化学键类型相同,熔点都很高
D. W、 X 形成的单质都是重要的半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】金刚烷胺是一种抗病毒药物, 可阻止病毒穿入宿主细胞并有明显地抑制病毒脱壳的作用,可用于流感病毒A型感染性疾病的治疗,其合成线路图如图所示。[尿素的分子式为CO(NH2)2]下列说法错误的是( )
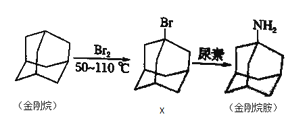
A.金刚烷的分子式是C10H16其不能使溴水和酸性KMnO4溶液褪色
B.中间产物X可发生消去反应,生成的有机产物只有一种
C.金刚烷胺碳原子上的一溴代物有两种
D.上述反应都属于取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】黄血盐[亚铁氰化钾K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10 mg/kg,一种制备黄血盐的工艺如下:
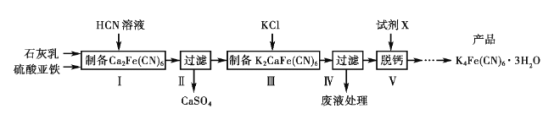
请回答下列问题:
(1)过滤需要用到的玻璃仪器有__________;写出中间产物CaSO4的一种用途__________。
(2)步骤I反应的化学方程式是___________。
(3)步骤V所用的试剂X是________(填化学式),在得到产品前还需经过的步骤包括____。
(4)工艺中用到剧毒的HCN溶液,含CN-等的废水必须处理后才能排放。
①CN-的电子式是_____________。
②处理含CN-废水的方法:第一步NaClO溶液先将CN-不完全氧化为OCN-;第二步NaClO溶液完全氧化OCN-生成N2和两种盐。第二步反应的离子方程式是_____。
(5)已知反应:
3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
现有Fe2+被氧化后的溶液,仅供选择的试剂:铁粉、铁氰化钾溶液、亚铁氰化钾溶液、KSCN溶液,请设计检验Fe2+是否氧化完全的实验方案_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯巴比妥是镇静、安眠类药物,其合成路线如下:
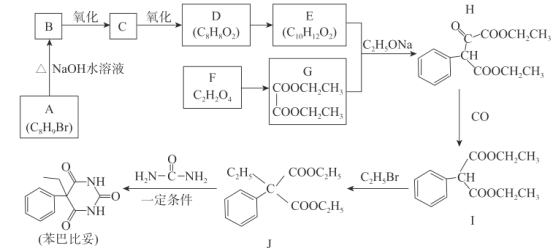
请回答下列问题:
(1)G的化学名称为_________,C的分子式为__________。
(2)F+X→G+ H2O,X的结构简式为____________。
(3)H中含有的官能团名称为__________,I→J的反应类型为______________。
(4)同时满足下列条件的E的同分异构体共有______种。
①含有苯环且苯环上有两个取代基
②能发生水解反应且能发生银镜反应
(5)化合物J→苯巴比妥的化学方程式为________________________________。
(6)以1,3-丁二烯、乙醇和尿素(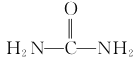 )为原料合成
)为原料合成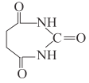 所需无机试剂任选,请写出流程:_____________________________
所需无机试剂任选,请写出流程:_____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,A的单质为密度最小的气体,B、W同周期,A、D同主族,A与W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式___________________________。
(2)由A、W元素组成的18电子分子的电子式为__________________________。
(3)D的一种氧化物可与B的最高价氧化物反应生成W的单质,试写出反应的化学方程式____________________________。
(4)向含有Fe2+和淀粉KI的溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I- 时,共转移3mol电子,该反应的离子方程式是_______________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放氢气,若将1mol DA和1mol E单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用沉淀滴定法快速测定NaBr等卤化物溶液中c(Br-),实验过程包括标准溶液的配制和滴定待测溶液。
I.标准溶液的配制
准确称取AgNO3基准物8.5g,配制成500mL标准溶液,放在棕色试剂瓶中避光保存,备用。
II.滴定的主要步骤
a.取待测NaBr溶液25.00mL,配制成100mL溶液,取其中25.00mL于锥形瓶中。
b.加入K2CrO4溶液作指示剂。
c.用AgNO3标准溶液进行滴定,记录消耗的体积。
d.重复上述操作三次,测定数据如下表:

e.数据处理。
请回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的玻璃仪器除烧杯和玻璃棒外还有___,配制的AgNO3溶液的浓度为___。
(2)AgNO3标准溶液应使用___ (填“酸式”或“碱式”)棕色滴定管,检漏后装液前需要进行的操作有___。
(3)实验可用铬酸钾(K2CrO4)作指示剂,一方面,是由于Ag2CrO4是砖红色沉淀,现象变化明显,另一方面,是由于___。
(4)滴定应在近中性或弱碱性(6.5<pH<10.5)的条件下进行,其原因是酸性过强,发生如下离子反应:___;碱性过强,会导致___。
(5)达到滴定终点时的现象为___。
(6)由上述实验数据测得原溶液c(Br-)=___ mol·L-1。
(7)若在配制AgNO3标准溶液时,未洗涤玻璃棒和烧杯,则对c(Br-)测定结果的影响为___ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH =﹣566 kJ/mol
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2B.1∶3C.2∶3D.3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期元素在生产生活中具有重要的作用。请回答下列问题:
(1)基态Sc原子的价电子排布图为___________________。
(2)Zn2+和CN-、K+可组成化合物K2Zn(CN)4,其中存在的化学键类型有____________;Zn(CN)42-中的配体为_______,配位原子为_____ ,与该配离子中配体等电子体的分子为___。
(3)与Br同主族的短周期元素有F、Cl,这三种元素的简单氢化物HF、HCl、HBr的沸点从高到低的顺序为___________,理由为______。
(4)Fe-Cr-Al合金可作为汽车尾气催化剂的载体,汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为_____。HNO3的酸性强于HNO2的原因为____________________。
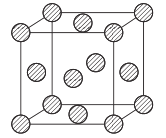
(5)金属铜采用面心立方堆积方式,其晶胞结构如图所示。已知该晶胞的密度为ρg. cm-3,晶胞参数为anm,阿伏伽德罗常数为NA,则铜原子的相对原子质量的表达式为_______(用含有ρ、a、NA的表达式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的综合利用是一个减少污染、提高燃料利用率的重要课题,其常用的方法包括煤的气化、液化以及转化为有机产品等。请回答下列问题:
(1)已知:I.C(s)、CO(g)、H2(g)的燃烧热依次为△H1=-393.5kJ·mol-1、△H2=-283.0kJ·mol-1、△H3=-285.8kJ·mol-1
II.H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=___。
CO(g)+H2(g)的△H=___。
(2)现在一恒温的刚性容器中加入足量煤,并通入1mol水蒸气,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
①气体的密度保持不变;②断裂2molH-O键的同时生成1molH-H键;③CO的体积分数保持不变;④气体的平均摩尔质量不变;⑤CO与H2的比例保持不变;⑥容器的压强保持不变。
(3)气化后,将水煤气CO与H2化合CO(g)+2H2(g)![]() CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
(4)关于CO(g)+2H2(g)![]() CH3OH(g),下列说法正确的是___(填字母)。
CH3OH(g),下列说法正确的是___(填字母)。
A.加压有利于速率加快和平衡向正反应方向移动
B.甲醇的平衡体积分数随着CO与H2投料比的增大而增大
C.使用催化性能好的催化剂,可提高H2的平衡转化率
D.在恒温恒容条件下达到平衡后,通入Ar,平衡向逆反应方向移动
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)](E表示物质的能量),则降温有利于提高正反应进行的程度
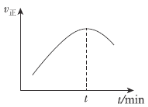
(5)在一特殊的恒容容器中,充入一定量的CO(g)与H2(g)来模拟CO(g)+2H2(g)![]() CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
(6)煤经过一系列转化还可得到草酸。常温下,向某浓度的草酸溶液中加入一定量某浓度的NaOH溶液,所得溶液中c(HC2O4-)=c(C2O42-),则此时溶液的pH=___(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com