
科目: 来源: 题型:
【题目】液相催化还原法去除水体中![]() 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
Ⅰ.制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
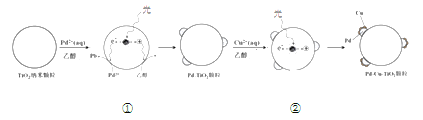
(1)该过程中,乙醇发生__________(填“氧化”或“还原”)反应。
(2)请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图_______。
Ⅱ.Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,不同pH时,反应1小时后![]() 转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
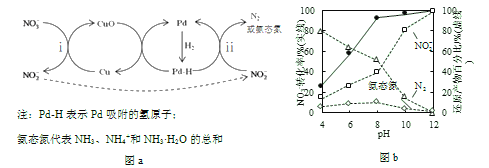
(3)该液相催化还原法中所用的还原剂是__________。
(4)i的离子方程式是__________。
(5)研究表明,OH–在Pd表面与![]() 竞争吸附,会降低Pd吸附
竞争吸附,会降低Pd吸附![]() 的能力,但对Pd吸附H的能力影响不大。
的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是____________,导致反应ⅱ的化学反应速率降低。
②随pH减小,还原产物中![]() 的变化趋势是__________,说明Pd表面吸附的
的变化趋势是__________,说明Pd表面吸附的![]() 和H的个数比变大,对反应__________(用离子方程式表示)更有利。
和H的个数比变大,对反应__________(用离子方程式表示)更有利。
(7)使用Pd-Cu/TiO2,通过调节溶液pH,可将![]() 尽可能多地转化为N2,具体方法是__________。
尽可能多地转化为N2,具体方法是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3C + 2K2Cr2O7 + 8H2SO4(稀)= 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 + 8 H2O
请回答下列问题。
(1)H2O的摩尔质量为___________,0.18g H2O的物质的量为_______________mol
(2)配制0.1mol/L H2SO4溶液500mL,则需要H2SO4的质量为_____________g
(3)在上述的反应中,若生成22g CO2
ⅰ.标准状况下,CO2的体积为_________L
ⅱ.转移电子的数目为________________
(4)标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,则该混合气体的平均相对分子质量是_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A. 将40gNaOH固体溶于1L水中
B. 将22.4 L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合
D. 将10g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】研究来源于真菌的天然产物L的合成对抗肿瘤药物研发有着重要意义,其合成路线主要分为两个阶段:
I.合成中间体F

已知:ⅰ.TBSCl为![]()
ⅱ. 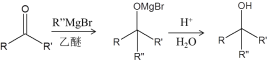
(1)A中含氧官能团名称__________。
(2)B的结构简式是__________。
(3)试剂a是__________。
(4)TBSCl的作用是__________。
II. 合成有机物L

已知: ![]()
(5)H中含有两个酯基,H的结构简式是__________。
(6)I→J的反应方程式是__________。
(7)K→L的转化中,两步反应的反应类型依次是__________、__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠是一种应用广泛的金属,钠及其化合物在生产生活中应用广泛。某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
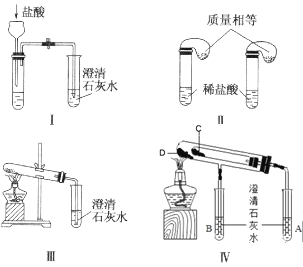
(1)只根据图中装置Ⅰ、Ⅱ所示实验,能够达到实验目的的是__(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式__、__;Ⅳ中现象为___;与实验Ⅲ相比,实验Ⅳ的优点___。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管C中装入的固体是__(填化学式)。
(4)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是__(填写字母)
A.稀硫酸 B.氯化钠溶液 C.氯化镁溶液 D.硫酸铜溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】观察下列实验装置图,按要求作答:

(1)写出图中实验操作的名称:①_____ ③_____
(2)装置④中所有玻璃仪器的名称:_____,_____
(3)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
从 KCl溶液中获取KCl晶体_____;从海水中提取水_____;分离CaCO3和水_____;分离植物油和水_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,密闭容器中发生反应:A(g)+3B(g) ![]() 2C(g),下列有关说法正确的是
2C(g),下列有关说法正确的是
A.若加入催化剂,则反应的△H 增大
B.加压时,平衡向正反应方向移动,反应的平衡常数增大
C.若反应温度升高,则活化分子的百分数增大,反应速率增大
D.若低温时,该反应为正向自发进行,则△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】文物是人类宝贵的历史文化遗产,我国文物资源丰富,但保存完好的铁器比青铜器少得多,研究铁质文物的保护意义重大。

(1)铁刃铜钺中,铁质部分比铜质部分锈蚀严重,其主要原因是________。
(2)已知:
ⅰ.铁质文物在潮湿的土壤中主要发生吸氧腐蚀,表面生成疏松的FeOOH;
ⅱ.铁质文物在干燥的土壤中表面会生成致密的Fe2O3,过程如下。
![]()
①写出ⅰ中,O2参与反应的电极反应式和化学方程式:________、________。
②若ⅱ中每一步反应转化的铁元素质量相等,则三步反应中电子转移数之比为________。
③结合已知信息分析,铁质文物在潮湿的土壤中比在干燥的土壤中锈蚀严重的主要原因是________。
(3)(资料1)Cl–体积小穿透能力强,可将致密氧化膜转化成易溶解的氯化物而促进铁质文物继续锈蚀。
(资料2)Cl–、Br–、I–促进铁器皿继续锈蚀的能力逐渐减弱。
①写出铁质文物表面的致密氧化膜被氯化钠破坏的化学方程式________。
②结合元素周期律解释“资料2”的原因是________。
(4)从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使Cl-渗出后,取最后一次浸泡液加入试剂 ________(填化学式)检验脱氯处理是否达标。
(5)经脱氯、干燥处理后的铁质文物再“覆盖”一层透明的高分子膜可以有效防止其在空气中锈蚀。下图为其中一种高分子膜的片段:
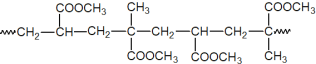
该高分子的单体是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A________,B________,C________,D________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性(除稀有气体外)最大的元素是_________。
(4)E元素原子的核电荷数是_________,E元素在周期表的第_______周期第_______族,在________区。
(5)写出D元素原子构成单质的电子式___________,该分子中有_______个σ键,_______个π键。
查看答案和解析>>
科目: 来源: 题型:
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com