
科目: 来源: 题型:
【题目】以CH3CH=CH2、NH3、O2为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的化学方程式分别为:反应Ⅰ.2C3H6+2NH3+3O2![]() 2C3H3N(g)+6H2O(g);反应Ⅱ.C3H6+O2
2C3H3N(g)+6H2O(g);反应Ⅱ.C3H6+O2![]() C3H4O(g)+H2O(g)。反应相同时间,丙烯腈产率与反应温度的关系如图a所示,丙烯腈和丙烯醛的平衡产率与
C3H4O(g)+H2O(g)。反应相同时间,丙烯腈产率与反应温度的关系如图a所示,丙烯腈和丙烯醛的平衡产率与![]() 的关系如图b所示。下列说法正确的是(丙烯腈的选择性=
的关系如图b所示。下列说法正确的是(丙烯腈的选择性=![]() ×100%)( )
×100%)( )
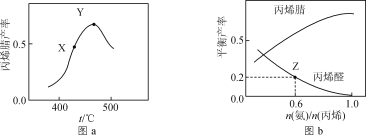
A.其他条件不变,增大压强有利于提高丙烯腈平衡产率
B.图a中X点所示条件下,延长反应时间能提高丙烯腈产率
C.图a中Y点所示条件下,改用对丙烯腈选择性更好的催化剂能提高丙烯腈产率
D.由图b中Z点可知,该温度下反应Ⅱ的平衡常数为K=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】炼油厂烷基化反应产生的废液中含硫酸91%、难挥发有机物7%。实验室以软锰矿(主要含MnO2,还含少量Fe、Al等元素)处理废液并制取MnSO4·H2O晶体,其实验流程如图:
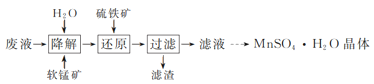
(1)研究温度对“降解”过程中有机物去除率的影响,实验在如图1所示的装置中进行。
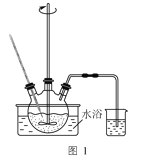
①在不同温度下反应相同时间,发现温度从60℃升高到95℃时,有机物去除率从29%增大到58%,其可能的原因是:MnO2的氧化能力随温度升高而增强;__。
②废液因含有机物而呈现黑红色。有机物降解速率慢,难以观察气泡产生速率。降解一段时间,判断有机物浓度基本不变的依据是:三颈烧瓶内__。烧杯中盛放的试剂可以是__。
(2)降解一段时间后,加入硫铁矿(主要成分FeS2)将剩余MnO2还原,所得溶液中的主要离子有Fe3+、Mn2+、SO42-等,其离子方程式为__。
(3)滤液若用足量高纯度MnO2再次氧化降解,改变条件,有机物去除率可达66%。反应后过滤,所得滤渣经洗涤后,在本实验流程中可用于__。
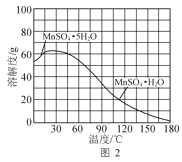
(4)MnSO4·H2O的溶解度曲线如图2所示。设计以过滤所得滤液为原料,进一步除去有机物等杂质并制取MnSO4·H2O晶体的实验方案:__,趁热过滤,用热的硫酸锰溶液洗涤,150℃烘干。[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;MnSO4·H2O分解温度为200℃。实验中必须使用的试剂:石灰石粉末、活性炭]
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸钴可用于制备有机合成中间体。一种以铜钴矿为原料,生产草酸钴晶体(CoC2O4·2H2O)的工艺流程如图:

已知:①“浸出”液含有的离子主要有H+、Fe3+、Cu2+、Co2+、SO42-;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体;
③25℃时,Ksp[Co(OH)2]=1.6×10-15。
(1)①生产时为提高铜钴矿粉浸出率,常采取的措施有___(填字母)。
a.高温浸出 b.适当延长浸出时间 c.分批加入细菌浸取液并搅拌
②铜钴矿粉也可采用在90℃、酸性条件下,加入适当还原剂进行浸出。若用Na2SO3为还原剂,浸出钴的主要化学反应为Co2O3+2H2SO4+Na2SO3![]() 2CoSO4+2H2O+Na2SO4。除考虑成本因素外,还原剂不选用浸出率更高的NaNO2的原因是___。
2CoSO4+2H2O+Na2SO4。除考虑成本因素外,还原剂不选用浸出率更高的NaNO2的原因是___。
(2)“萃取”步骤中萃取除去的主要金属阳离子是___。
(3)“氧化”过程中,控制70℃、pH=4条件下进行,pH对除铁率和钴回收率的影响如图所示。
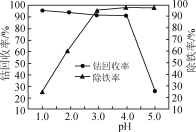
①“氧化”过程的离子方程式为___。
②pH为4~5时,钴的回收率降低的原因是___。
(4)300℃时,在空气中煅烧CoC2O4·2H2O可制得CO3O4,该反应的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol·L-1的是( )
A. 将20g NaOH固体溶解在500mL水中
B. 将10g NaOH固体溶解在水中配成250mL溶液
C. 将1L 10 mol·L-1的浓盐酸与9L水混合
D. 将标准状况下22.4L HCl气体溶于1L水中配成溶液(已知HCl极易溶于水,0℃时,1体积水能溶解500体积的氯化氢)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
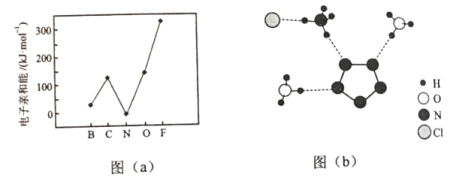
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5—中的大π键应表示为____________。
),则N5—中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)NH…Cl、____________、____________。
(4)R的晶体密度为d g·cm3,其立方晶胞参数为a nm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于0.1mol/LH2SO4溶液的叙述错误的是
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2Cr2O4。考虑到胶体的吸附作用使Na2Cr2O4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图1),使浆液分离成固体混合物和含铬元素溶液,并回收利用。

固体混合物的分离和利用的流程图如图2所示(流程图中的部分分离操作和反应条件未标明):

(1)反应①所加试剂NaOH的电子式为___,B→C的反应条件为___,C→Al的制备方法称为___。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有___(填序号)。
a.温度 b.Cl-的浓度 c.溶液的酸度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com