
科目: 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头表示配位键)。下列说法不正确的是( )
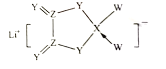
A.W的非金属性比Y的强
B.该物质中X原子满足8电子稳定结构
C.该物质中含离子键和共价键
D.Z的氧化物都易溶于水中
查看答案和解析>>
科目: 来源: 题型:
【题目】从粉煤灰(含莫来石、石英等)中回收![]() 的一种工艺流程如下:
的一种工艺流程如下:
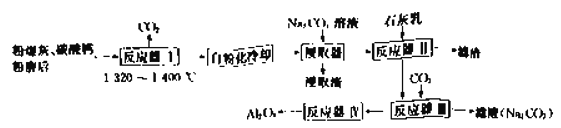
(1)经反应器I可使莫来石和石英转化为![]() (硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的
(硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的![]() 得到活化。
得到活化。
(2)控制条件,经反应器I烧结后固体自身不需要机械加工即可变成粉末,“自粉化”的意义是_______。
(3)浸取器中,适量增大![]() 溶液的投料,有利于提高铝酸钙转化为
溶液的投料,有利于提高铝酸钙转化为![]() 的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
(4)反应器Ⅲ中发生反应的离子方程式为:__________________________________。
(5)反应器Ⅳ采取工艺方法是_____________________;上述工艺流程中可以循环使用的物质是_______________________________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】奶油中含有一种化合物A,可用作香料。在空气中长时间搅拌奶油,A可转化为化合物B。A发生的一系列化学反应如下:

完成下列填空:
(1)写出反应类型:反应 ①_________________________反应 ②_________________________
(2)写出反应③所需的试剂与条件:_________________________________
(3)写出结构简式:F________________________
(4)写出一种满足下列要求的A的同分异构体的结构简式:_______________________
i.含有酯基 ii.能发生银镜反应
(5)写出C→D反应的化学方程式:________________________________________________
(6)C也能与乙二酸反应形成环状化合物(C6H8O4),写出该环状化合物的结构简式:__________
(7)写出以C为原料合成1,4-丁二醇(![]() )的合成路线__________。(合成路线常用的表示方式为:
)的合成路线__________。(合成路线常用的表示方式为:![]()
![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】氯及其化合物在工业生产生活中有很重要的作用。已知:实验室中可用KClO3与浓盐酸发生如下反应:
(_____)KClO 3+(_____)HCl(浓)-(_____)KCl+(_____)Cl2↑+(____) H2O,
(1)请配平该反应,并用双线桥法标出电子转移的方向和数目。______________
(2)该反应中氧化剂为______;氧化剂与还原剂的物质的量之比为______;氧化产物与还原产物的物质的量之比为______;被氧化的元素和被还原的元素的质量之比为_________。
(3)浓盐酸在反应中表现出来的性质是________________(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸
(4)当此反应中产生标准状况下13.44L的Cl2 ,则该反应转移的电子的数目为_____;被氧化的盐酸的物质的量为______mol,参加反应的盐酸的物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g) + 3H2(g) ![]() 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1 ________K2(填写“>”、“=”或“<”)
(2) 400℃时,反应2NH3(g) ![]() N2(g) + 3H2(g)的化学平衡常数的值为_____________。
N2(g) + 3H2(g)的化学平衡常数的值为_____________。
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) ___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中NH4+的浓度_______(填“增大”、“减小”或“不变”),其原因是_________________________________________________________。
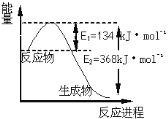
(6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 _____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。下列说法正确的是

A.溶液中一定不含有的溶质是MgCl2、NH4Cl
B.溶液中可能含有的溶质是KCl、Na2CO3
C.溶液中一定含有的溶质是HCl、AlCl3、NH4Cl
D.AB段发生反应的离子方程式为Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为_________ mol。
(2)在方法二中,反应物H2C2O4_________(填序号)。
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)两种方法相比,___________(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是______________________________________________。
(4)实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 ________________________________________________。
(5)氯原子核外共有______种不同运动状态的电子,氯离子的最外层电子排布式是________。
(6)CCl4分子的空间构型为__________________,CO2的电子式是___________________。
(7)相同压强下,部分元素氯化物的熔点见表:
氯化物 | NaCl | KCl | CCl4 |
熔点/℃ | 804 | 773 | -22.92 |
试解释表中氯化物熔点差异的原因:_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。

(1)写出下列仪器的名称:a.__________,b._____________。
(2)若利用装置1分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,冷凝水由________(填f或g) 口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_______________。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应用托盘天平称取Na2CO3·10H2O 的质量是____g。
②装置III是某同学转移溶液的示意图。图中的错误是_______________。
③除了图中给出的仪器和托盘天平以及烧杯外,为完成实验还需要的仪器有:______________。
Ⅱ利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至________。
(2)滴定:取0.00950 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-===S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】右图是可逆反应A+2B ![]() 2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是
2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是

A.A、B一定是气体
B.C可能是气体
C.D一定不是气体
D.正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com