
科目: 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯的操作步骤和加入试剂的情况如图:
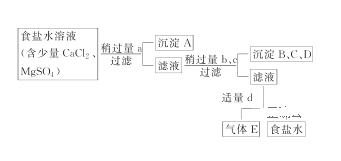
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是___________________。
加入适量d后溶液中发生反应的离子方程式为___________________________。
(3)现有下列仪器,过滤出沉淀A、B、C、D时必须用到________(填序号),仪器③的名称是________。
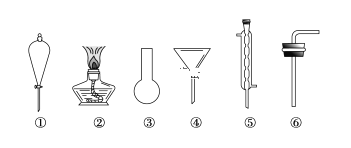
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是________(填序号)。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的________(填序号),该仪器名称为________,向该碘水中加入四氯化碳以提取碘单质的实验操作为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
(1)单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2O![]() H3O++OH-),IF5的自偶电离方程式为_________
H3O++OH-),IF5的自偶电离方程式为_________
(2)亚硫酸钠和碘酸钾在酸性溶液中的反应是:Na2SO3+KIO3+H2SO4 →Na2SO4+K2SO4+I2+H2O(未配平)该反应过程和机理较复杂,一般认为分为以下步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO-+SO42-(快)
③5I-+6H++I03-→3I2+3H2O(快)
④I2+SO32-+H2O-→2I+SO42-+2H+(快)
根据上述条件推测,此反应的总反应速率由_______步反应决定(填序号)。若预先加人淀粉溶液,由题述看必在_____________离子消耗完时,才会有淀粉变蓝的现象产生。
(3)离子的吸附是重要的研究课题
①已知SO2与I2的反应,速率极快且平衡常数大溶液中存在如下平衡:I2(aq)+l-(aq)=l3-(aq)现将1 mol SO2缓通入含1mol l2的水溶液中至恰好完全反应溶液中l3-的物质的量n(l3-)时间(t)的变化曲线如图1所示。开始阶段,n(l3-)逐渐增大的原因是_____
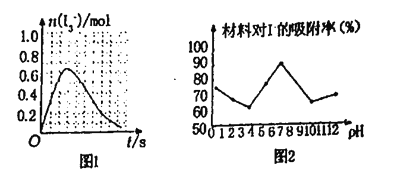
②科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___________(填“酸性”“中性”或“碱性”)溶液中的I-。
③氯化银复合吸附剂也可有效吸附碘离子氯化银复合吸附剂对碘离子的吸附反应为:I-(aq)+AgCl(s)=Agl(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=1.0mol·L-1.则溶液中c(I-)=______mol·L-1[k(AgCl)=2.0×10-10,k(Agl)=8.4×10-17]
(4)Fe3+与I-在溶液中发生反应:2Fe3++2I- ![]() 2Fe2++I2,该反应的正反应速率和Fe2+与I-的浓度关系为v=k·cm(I-)·cn(Fe3+)(其中k为常数)。T℃时,实验测得c(I-)、c(Fe3+)与反应速率的关系如下表:
2Fe2++I2,该反应的正反应速率和Fe2+与I-的浓度关系为v=k·cm(I-)·cn(Fe3+)(其中k为常数)。T℃时,实验测得c(I-)、c(Fe3+)与反应速率的关系如下表:
c(I-)/molL-1 | c(Fe3+)/molL-1 | v/molL-1s-1 | |
① | 0.20 | 0.80 | 0.032k |
② | 0.60 | 0.40 | 0.144k |
③ | 0.80 | 0.20 | 0.128k |
①在v=k·cm(I-)·cn(Fe3+)中m、n的值为_____________(填序号)
A.m=1n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响_____(填“大于”、“小于”或“等于”)Fe3+浓度对反应速率的影响。
查看答案和解析>>
科目: 来源: 题型:
【题目】据统计城市机动车辆每年以15%至20%的速度增长,交通事故也频发,汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。则下列判断正确的是
A. 还原剂与氧化产物的物质的量之比为5:8
B. 若氧化产物比还原产物多1.4mol则转移电子为1mol
C. 每生成1.6mol氮气,则有0.2molKNO3被氧化
D. NaN3是只含有离子键的离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列十种物质:①AgCl②铜③液态醋酸④CO2⑤H2SO4⑥Ba(OH)2固体⑦NaHCO3⑧稀硝酸⑨熔融FeCl3 ⑩NaHSO4
(1)上述状态下可导电的是_________;(填序号,下同)属于强电解质的是________;属于非电解质的是______.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为_______________________________
(3)用⑨的饱和溶液制备Fe(OH)3胶体的离子方程式_______________________ 足量的④通入⑥的溶液中的离子方程式______________;
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为氢气燃烧的实验。发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈红色。下列说法不正确的是

A. 将烧杯中溶液换成氢硫酸溶液,溶液无明显变化
B. 与酸性FeSO4溶液发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
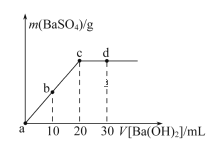
A.硫酸溶液的体积为25 mL
B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1
C.d时刻溶液中c(OH-)=0.05mol·L-1
D.溶液的导电能力:c<d<b<a
查看答案和解析>>
科目: 来源: 题型:
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
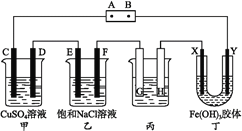
(1)电源A极的名称是____________。
(2)甲装置中电解反应的总化学方程式:______________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是____________。
(4)欲用丙装置给铜镀银,G应该是__________(填“铜”或“银”),电镀液的主要成分是___________(填化学式)。
(5)装置丁中的现象是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com