
科目: 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
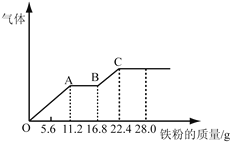
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3 | H2SO3 | HClO |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
K2=5.61×10-11 | K2=1.02×10-7 |
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质,
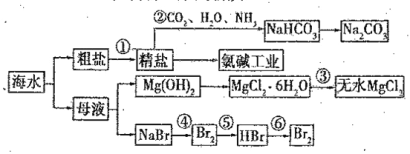
下列说法正确的是( )
A.步骤②中,应先通CO2 ,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的 SO42-、Ca2+ 、Mg2+ 等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在下列各组指定溶液中一定不能大量共存的离子组的个数是( )
①强酸性溶液中:Mg2+、K+、![]() 、
、![]()
②强碱性溶液中:Na+、Ba2+、![]() 、
、![]()
③在无色溶液中:H+、K+、![]() 、F-
、F-
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、![]() 、Cl-
、Cl-
⑤无色透明溶液中:![]() 、K+、Cl-、
、K+、Cl-、![]()
⑥无色透明的碱性溶液中:Na+、Ba2+、Cl-、![]()
A.一个B.两个C.三个D.四个
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA个CO2分子占有的体积为44.8L
C.标准状况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺为:
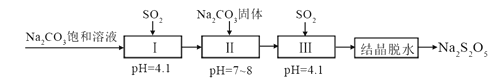
下列说法正确的是( )
A.pH=4.1时,Ⅰ中为Na2SO3溶液
B.Na2S2O5用作食品的抗氧化剂和SO2作漂白剂时,均表现还原性
C.工艺中加入Na2CO3固体、并再次充入SO2的目的是得到NaHSO3过饱和溶液
D.葡萄酒中Na2S2O5用作食品的漂白剂
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列五组物质:A、 O2和O3 B 、![]() Cl和
Cl和![]() Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与
Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与 E、
E、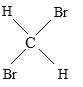 与
与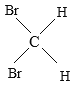
(1)______组两种物质互为同位素;
(2)______组两种物质互为同素异形体;
(3)______组两种物质互为同系物;
(4)______组两种物质互为同分异构体;
(5)______组两种物质实为同一物质。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如图所示。
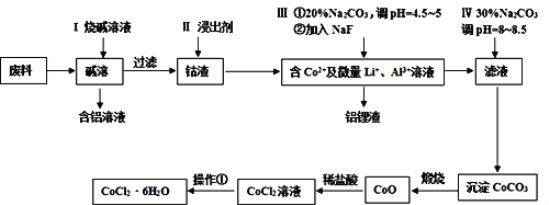
请回答下列问题:
(1)步骤I中发生反应的化学方程式_______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果_______;若步骤II中浸出剂为硫酸,写出Co2O3与硫酸反应的化学方程式______。
(3)步骤Ⅲ中①的目的是除去Al3+,②的目的是除去Li+,写出除去Li+的离子方程式_______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_______、过滤、洗涤、干燥。用75%酒精代替蒸馏水洗涤,其优点是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中产生无色气体的化学式:_______。
(2)还原过程中发生的主要反应的离子方程式:______。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃ 干燥2h,冷却密封包装。70℃, 真空干燥、密封包装的原因是:______。
(4)滤液中主要成分是(NH4)2SO4,工业上用(NH4)2SO4与Al2(SO4)3制取铵明矾,铵明矾在食品,制革等方面有重要用途,写出铵明矾的化学式________。
(5)随着pH值减小[Cu2(OH)4-nCln]中Cu%_______。(填字母)
A.增大 B.不变 C.不能确定 D.减小
(6)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65 时,CuCl产率会下降,从生成物的角度分析,其原因可能是______。
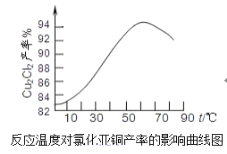
(7)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
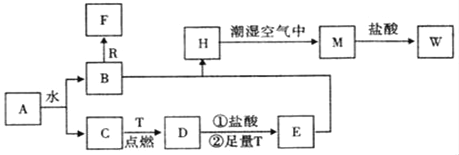
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com