
科目: 来源: 题型:
【题目】反应2A(g)![]() 2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压B.减压C.减小E的浓度D.降温
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验一:
如图所示为实验室制取蒸馏水的装置示意图。

根据图示回答下列问题:
图中两处明显错误是:
①________; ②________。
(2)A仪器的名称是________, B仪器的名称是________。
(3)实验时,A中除加入少量自来水外,还需要加入少量的________,其作用是________。
(4)实验二:
碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4,该小组先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,转移到分液漏斗中,再加入一定量的苯,振荡。分液漏斗使用前应先________,振荡后上层液体为________(填有机层、水层)。
(5)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是______
A.不与碘反应
B.碘在其中的溶解度远大于在水中的溶解度
C.该萃取剂与水不互溶且密度比水大
D.可以选用CCl4、酒精做萃取剂
(6)某学生在一次分液操作中发现上下层溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断方法________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
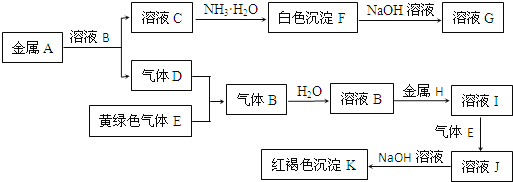
(1)写出下列物质的化学式:
A是_______________,D是___________,K是_______________。
(2)写出反应“C→F”的离子方程式:_______________________。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
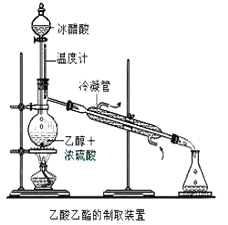
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
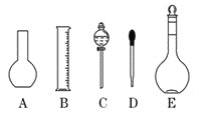
(1)实验室需要0.1 mol/L NaOH溶液480 mL, 根据溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);
②由计算得知,应选择________mL的容量瓶,用托盘天平称取________g NaOH。
③在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线, 则所配制溶液浓度________0.1 mol/L (填“大于”“等于”或“小于”,下同);溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使所配制溶液浓度________0.1 mol/L。
(2)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.蒸发结晶 D.过滤 E.蒸馏 F.分液
①除去洗菜水里的菜叶子和泥土________;
②从食盐水里获得食盐固体________;
③从碘和沙子混合物中获得碘________;
④从溴水中获得溴________;
⑤分离CCl4 沸点为76.75℃和甲苯沸点为110.6℃的混合物________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的高锰酸钾反应(不加热),来制取氯气。
反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)“双线桥法”标出电子转移情况________。
(2)若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克KMnO4参加反应?________。
②被氧化的HCl的物质的量为多少?________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A. 反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C. 反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D. 反应2Na+2H2O===2NaOH+H2↑中,H2O既是氧化剂又是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强B. 混合气体的密度
C. 3v逆(C)=2v正(B)D. 气体的平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com